题目内容
2.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.(1)检验溶液中Fe3+存在的试剂是KSCN溶液,证明Fe3+存在的现象是溶液变红.
(2)写出FeCl3溶液与金属铜发生反应的离子方程式2FeCl3+Cu═2FeCl2+CuCl2.
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用如图步骤:
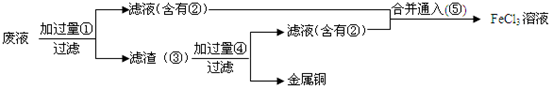
A.请写出上述实验中加入或生成的有关物质的化学式:
①Fe,②FeCl2,④HCl.
B.含有②的滤液与⑤反应的化学方程式为2FeCl2+Cl2═2FeCl3.
分析 (1)检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
(2)铜与氯化铁反应生成氯化铁、氯化亚铁;
(3)腐蚀废液中含有氯化铜、氯化亚铁以及氯化铁,铁可以置换金属铜,可以和三价铁反应,铜不能盐酸反应,而金属铁可以,氯气具有氧化性,能将亚铁离子氧化为三价铁.
解答 解:(1)检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,
故答案为:KSCN溶液;溶液变红;
(2)铜与氯化铁反应生成氯化铁、氯化亚铁,反应方程式为:2FeCl3+Cu═2FeCl2+CuCl2,故答案为:2FeCl3+Cu═2FeCl2+CuCl2;
(3)A.腐蚀废液中含有氯化铜、氯化亚铁即氯化铁,加入过量的铁可以和氯化铁反应生成氯化亚铁,和氯化铜反应生成金属铜和氯化亚铁,故①是铁,滤液②中含FeCl2,滤渣③中含铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入足量的盐酸可以将铜分离,故过量的④为盐酸,得到的滤液④是氯化亚铁,氯气具有氧化性,能将亚铁离子氧化为三价铁,故⑤是氯气,
故答案为:①Fe,②FeCl2,④HCl;
B.氯气具有氧化性,能将亚铁离子氧化为三价铁,实质是:2FeCl2+Cl2═2FeCl3,故答案为:2FeCl2+Cl2═2FeCl3.
点评 本题考查了铁及其化合物性质的分析判断,主要是铁离子和亚铁离子的检验以及铁的化合物的有关反应,题目难度中等.

练习册系列答案
相关题目
12.工业上制肥皂时,常向皂化反应混合物中加入食盐颗粒,使高级脂肪酸钠析出,这一过程被称为( )
| A. | 蒸馏 | B. | 盐析 | C. | 过滤 | D. | 吸附 |
13.下列关于钠的化合物的说法不科学的是( )
| A. | 可用焰色反应鉴别Na2SO4和NaCl | |
| B. | 加热分解NaHCO3可得Na2CO3,说明NaHCO3热稳定性比Na2CO3差 | |
| C. | 将mgCO完全燃烧后的产物通入到足量Na2O2固体中,固体增加的质量为mg | |
| D. | 利用Na2CO3溶液和稀盐酸相互滴加时,顺序不同则现象不同,可用此法鉴别Na2CO3溶液和稀盐酸 |
10.关于物质的量的叙述正确的是( )
| A. | 常温常压下,4.4gCO2物质的量为0.1 mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1 NA个H2O分子含有氢分子数为1 mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
17.下列叙述正确的是( )
| A. | 将钠放入硫酸铜溶液中可置换出铜 | |
| B. | 铜丝在氯气中燃烧,产生蓝色的烟 | |
| C. | 向氯化铁溶液中滴入KOH溶液,可产生红褐色胶体 | |
| D. | 氢气在氯气中燃烧,火焰呈苍白色 |
7.用赤铁矿为原料冶炼铁,应采取的冶炼方法是( )
| A. | 电解法 | B. | 热氧化法 | C. | 热还原法 | D. | 热分解法 |
14.人体血液的pH保持在7.35~7.45,适量的CO2可以维持这个pH变化范围,可用下面的化学方程式表示:H2O+CO2???H2CO3???H++HCO3-,又知人体呼出的气体中CO2的体积分数约为5%,下列说法正确的是( )
| A. | 太快而且太深的呼吸可导致碱中毒 | |
| B. | 太快而且太深的呼吸可导致酸中毒 | |
| C. | 太浅的呼吸可导致碱中毒 | |
| D. | 太浅的呼吸不会导致酸中毒或碱中毒 |
11.将下列离子混合在同一溶液中,必然会产生沉淀的一组是( )
| A. | Na+、Al3+、Cl-、AlO2- | B. | Ba2+、NH4+、Cl-、OH-、 | ||
| C. | H3O+、Cu2+、SO42-、Cl- | D. | Na+、Al3+、Cl-、H+ |
12.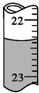 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )| A. | 22.30 mL | B. | 22.35 mL | C. | 23.65 mL | D. | 23.70 mL |