题目内容
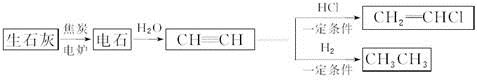
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
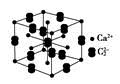
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: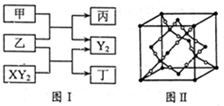
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中, 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
(12分,每空2分)
(1)2Na2O2+2H2O==4NaOH+O2↑
(2)sp3 1∶1 24
(3)O>C>H>Na
(4)2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O
解析试题分析:常温下0.01mol/L-1丙溶液PH=12,说明丙为强碱,短周期元素形成,应为NaOH,根据反应框图可知:甲为H2O,乙为Na2O2,XY2为CO2,Y2为O2,丁为Na2CO3,W、X、Y、Z是原子序数依次增大的短周期元素,分别为:H、C、O、Na。
(1)甲为H2O,乙为Na2O2,所以化学方程式为:2Na2O2+2H2O==4NaOH+O2↑
(2)甲的中心原子为O,O形成了2个σ键,还有2对孤对电子,所以杂化方式为sp3;CO2分子结构式为:O=C=O,含有2个σ键和2个π键,所以σ键与π键的数目之比为1:1;根据CO2的原子晶体晶胞图,C分子位于8个顶点,6个面心和4个晶胞内部,则含C原子:8×1/8+6×1/2+4=8,O原子都位于晶胞内部,16个,所以1个晶胞中含有24个原子。
(3)根据H、C、O、Na在元素周期表中的位置可知电负性由大到小的顺序是:O>C>H>Na
(4)次氯酸中Cl元素的化合价为+1,则次氯酸的酸酐为Cl2O,氯气与潮湿的丁反应制备次氯酸的酸酐,同时生成小苏打和食盐混合物,所以化学方程式为:2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O
考点:本题考查元素与物质的推断、杂化轨道和化学键的判断、晶胞的分析、电负性、化学方程式的书写。

下表所列是元素周期表部分短周期的主族元素
| | W | X | Y | |
| R | | | | Z |
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l) △H1=—195kJ?mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g) △H2=—534.2kJ?mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g)
 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | ⑨ |
元素是 。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,只写出反应的化学方程式(不写实验步骤)______________________________________
(3)⑤与⑥两元素最高价氧化物的水化物相互反应的离子方程式为 _____________________________________________________
(4)③的氢化物的电子式为__________________
(5)①④⑤三种元素形成的最简单一种化合物含有的化学键类型有
下列物质中σ键和π键数目比为1 :2的是
| A.O2 | B.HCN | C.CO2 | D.N2 |

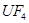 +
+ 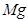 ——
——  +
+ 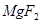
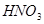 ——
—— 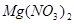 +
+ 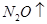 +
+ 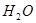
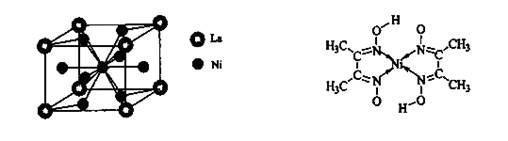
 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;