题目内容
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式 。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是___________________________________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子 。
(1) 5: 1 n CH2=CH2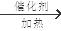
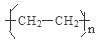 (2)极性分子;
(2)极性分子; ;2 Fe2+ +2H2O2+2H+=2Fe3++2H2O (3)
;2 Fe2+ +2H2O2+2H+=2Fe3++2H2O (3)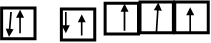 ;NH3中有氢键。(4) 直线型 ,非极性分子
;NH3中有氢键。(4) 直线型 ,非极性分子
解析试题分析:根据题意可知:A的H;B是N;C是O;D是 C。(1)H、C形成的某种化合物甲C2H4是一种重要的化工产品,可用作水果和蔬菜的催熟剂,在C2H4分子中σ键是5个和π键数目是1个,所以个数之比为5:1 。由乙烯制高聚物聚乙烯的反应方程式为n CH2=CH2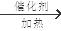
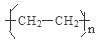 。(2)A、C形成的某种化合物乙分子中含非极性共价键,则乙分子是H2O2,由于各个化学键的空间排列不对称,所以属于极性分子,其电子式是
。(2)A、C形成的某种化合物乙分子中含非极性共价键,则乙分子是H2O2,由于各个化学键的空间排列不对称,所以属于极性分子,其电子式是 。将H2O2加入浅绿色酸性FeCl2溶液中,溶液变为棕黄色,该反应的离子方程式是2 Fe2+ +2H2O2+2H+=2Fe3++2H2O。(3)B原子的基态原子电子排布图为
。将H2O2加入浅绿色酸性FeCl2溶液中,溶液变为棕黄色,该反应的离子方程式是2 Fe2+ +2H2O2+2H+=2Fe3++2H2O。(3)B原子的基态原子电子排布图为 。与PH3相比,NH3易液化的主要原因是因为在分子之间存在氢键,增加了分子之间的相互作用力。(4)笑气(N2O)是一种麻醉剂,有关理论认为N2O 与CO2分子具有相似的结构。因为CO2分子是直线型分子,故B2C的空间构型是直线型。由于各个化学键的空间排列的对称的所以该分子为非极性分子。
。与PH3相比,NH3易液化的主要原因是因为在分子之间存在氢键,增加了分子之间的相互作用力。(4)笑气(N2O)是一种麻醉剂,有关理论认为N2O 与CO2分子具有相似的结构。因为CO2分子是直线型分子,故B2C的空间构型是直线型。由于各个化学键的空间排列的对称的所以该分子为非极性分子。
考点:考查元素的推断、物质的结构、性质及化学方程式的书写的知识。

利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是___。
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |
(3) 工业上电解法处理亚硝酸盐的模拟工艺如图。

已知:阳极区发生化学反应:
2NO2-+8H++6Fe2+==N2↑ +6Fe3++4HzO
①阳极电极反应方程式是______(不考虑后续反应);
②若硫酸溶液浓度过大,阴极区会有气体逸出,该气体为______(填化学式);该现象表明c( H+ )越大,H+氧化性越______;
③若电解时电路中有0.6 mol电子转移,且NaNO2有剩余,则电解池中生成Na2SO4______mol。
(13分)[化学——物质结构与性质]由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
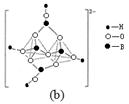
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。

某学生在做元素性质与原子结构的关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的。
探究同一主族元素性质的递变规律。
(2)实验用品。
仪器:试管、胶头滴管。
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容)。
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈________色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈________色 |
(4)实验结论:__________________________________________________________。
(5)问题和讨论。
①上述两个实验中发生反应的离子方程式分别为________、________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:________、________。
下列对σ键的认识不正确的是
| A.ss σ键与sp σ键的对称性相同 |
| B.烯烃分子中的碳碳双键的键能是碳碳单键键能的二倍 |
| C.分子中含有共价键,则至少含有一个σ键 |
| D.含有π键的化合物与只含σ键的化合物的化学性质不同 |
 键与π键的数目之比为_________;
键与π键的数目之比为_________; 键:
键:
 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。 的价层电子排布图为_____
的价层电子排布图为_____
