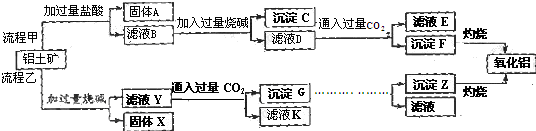
题目内容
16.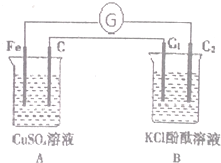 按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)
按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)(1)A池正极的电极反应式为Cu2++2e-=Cu,反应一段时间后,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,产生蓝色沉淀,反应的离子方程式为3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
(2)C2极区溶液变红的原因是水电离的H+反应生成H2,使C2极区C(OH-)增大,溶液变红
(3)当C1极区产生1.12L气体(标准状况)时,B池的pH=14(此时B中溶液的体积为0.1L)
分析 (1)A装置能自发的进行氧化还原反应,且符合原电池构成条件,为原电池,B为电解池;A中,铁易失电子发生氧化反应而作负极,碳作正极,铜离子防备电;
(2)石墨棒C2为阴极,阴极上氢离子得电子发生还原反应,所以氢氧根离子浓度变大,石墨棒C2溶液呈碱性;
(3)石墨棒C1为阳极,发生氧化反应氯离子放电生成氯气,根据电子转移数目相等,Cl2~2e-~2OH-,结合水的离子积常数,计算B池的pH.
解答 解:(1)A装置能自发的进行氧化还原反应,且符合原电池构成条件,为原电池,B为电解池,A中铁易失电子发生氧化反应而作负极,碳作正极,电极反应是铜离子得到电子生成单质铜,电极反应式为:Cu2++2e-=Cu,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,产生蓝色沉淀,反应的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,故答案为:Cu2++2e-=Cu;3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(2)石墨棒C2为阴极,阴极上氢离子得电子发生还原反应,所以氢氧根离子浓度变大,石墨棒C2溶液呈碱性,酚酞变红,
故答案为:水电离的H+反应生成H2,使C2极区C(OH-)增大,溶液变红;
(3)石墨棒C1为阳极,发生氧化反应氯离子放电生成氯气,根据电子转移数目相等,
由 Cl2 ~2e-~2OH-
22.4L 2mol
1.12L n(OH-)
解之得n(OH-)=$\frac{1.12L×2mol}{22.4L}$=0.1mol,所以 c(OH-)=$\frac{0.1mol}{0.1L}$=1mol/L,所以c(H+)=$\frac{1{0}^{-14}}{1}$=10-14mol/L,pH=14,故答案为:14.
点评 本题考查了原电池和电解池,正确判断原电池及正负极是解本题关键,再根据各个电极上发生的电极反应来分析解答,知道串联电路中转移电子相等,难度中等.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1mol N2和3mol H2,反应后放出的热量为Q1 kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
| A. | 反应CO(g)+NO2(g)?CO2(g)+NO(g),△H<0,达到平衡后,升高温度系颜色变深 | |
| B. | 高压比常压有利于SO2与O2合成SO3的反应. | |
| C. | 加入催化剂有利于N2与H2合成NH3的反应 | |
| D. | 工业制取金属钾[Na(l)]+KCl(l)?NaCl(l)+K(g)]选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是I(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

请比较二者酸性强弱:HIO3> H5IO6(填“>”、“<”或“=”).
(5)已知${{ClO}_{2}}^{-}$为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,写出一个ClO2-的等电子体Cl2O或OF2.
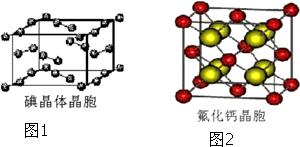
(6)如图1为碘晶体晶胞结构.有关说法中正确的是C.
A.用均摊法可知平均每个晶胞中有4个碘原子
B.碘晶体为无限延伸的空间结构,是原子晶体
C.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见如图2)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}ρN{\;}_{A}}{4}$.
| A. | 氢氧化钡溶液与硫酸反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| B. | 氧化铜和稀硫酸反应:CuO+2H+═Cu2++H2O | |
| C. | 碳酸氢钠溶液和稀硫酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 乙醇可以被氧化为乙酸,二者均能发生取代、氧化反应 | |
| C. | 甲烷、乙烯和苯在工业上都可通过石油分馏或裂化得到 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
 .
.