题目内容
17.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )| A. | H + NO3- Fe 2+ Na + | B. | Ag + NO3- Cl - K + | ||
| C. | K + Ba 2+ OH - SO42- | D. | Cu 2+ NH4+ Br - OH - |
分析 具有还原性的离子与氧化性的离子发生氧化还原反应,不能大量共存,以此来解答.
解答 解:A.Fe 2+具有还原性,H+和NO3-具有氧化性,三者发生氧化还原反应,不能大量共存,故A选;
B.Ag+和Cl-不能共存,因复分解反应不能大量共存,不发生氧化还原反应,故B不选;
C.Ba2+与SO42-反应生成BaSO4不能大量共存,因复分解反应不能大量共存,不发生氧化还原反应,故C不选;
D.Cu 2+与OH -、NH4+与OH-均不能共存,因复分解反应不能大量共存,不能发生氧化还原反应,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意硝酸根离子在酸性条件下表现出强氧化性,可以氧化还原某些物质,这一点往往容易疏忽,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列叙述正确的是( )
| A. | 核素就是同位素 | |
| B. | 元素的金属性强弱与元素失去电子数的多少成正比 | |
| C. | 具有相同质子数的微粒一定是同一种元素 | |
| D. | 核内中子数为N的R2+,质量数为A,则该离子的核外电子数为A-N-2 |
5.下列离子方程式与所述事实相符且正确的是( )
| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
2.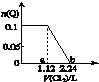 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
 向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )
向含Fe2+、Br-、I-各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中某种离子的物质的量的关系如图,下列说法中正确的是( )| A. | Q是I- | |
| B. | Q是Br- | |
| C. | ab区间的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | b点时溶液中只有Cl- |
9.下列有关实验原理、方法和结论都正确的是( )
| A. | 滴加盐酸酸化的BaCl2溶液,生成白色沉淀,原溶液中一定含有SO42- | |
| B. | 将钾盐溶于盐酸,产生能使澄清石灰水变浑浊的气体,该钾盐一定为K2C03 | |
| C. | 某固体进行焰色反应实验,火焰呈黄色,说明该固体为钠盐 | |
| D. | 向某溶液中滴加KSCN溶液,不变色,再滴加氯水显红色,则 溶液中一定含有Fe2+ |
6.现有以下两种有机物:① ②
②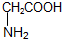 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ②
②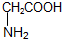 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 有机物①分子中所有原子不可能在同一平面上 | |
| B. | 有机物②与硝基乙烷(CH3CH2NO2)互为同分异构体 | |
| C. | 有机物①与②的核磁共振氢谱具有相同数目的吸收峰 | |
| D. | 有机物①能与浓溴水发生加成反应和取代反应 |
14.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.2Fe3++2I-═2Fe2++I2 I2+2S2O3═2I-+S4O62-已知:
则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.2Fe3++2I-═2Fe2++I2 I2+2S2O3═2I-+S4O62-已知:
则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)
 2-甲基戊烷
2-甲基戊烷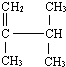 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯 1,2-二溴乙烷
1,2-二溴乙烷 乙苯
乙苯
 .
.