题目内容
2.无水氯化铝是白色晶体,露置在空气中极易水解,在178℃升华,装有无水氯化铝试剂瓶置露空气中,会产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂,并用于处润滑油等.如图是实验室制取少量无水氯化铝装置的仪器和药品.可供选用的试剂如下:A.食盐晶体 B.水 C.饱和食盐水 D.烧碱溶液 E.铝粉
F.二氧化锰 G.浓硫酸 H.无水CaCl2 I.碱石灰
回答下列问题:
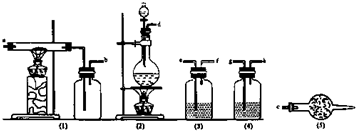
(1)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e,f接g,h接a,b接c.
(2)填写连接装置中各选用仪器里应盛放的物质:
| 仪器标号 | 1 | 2 | 3 | 4 | 5 |
| 试剂标号 | E | AFG | C | G | I |
分析 实验室用浓盐酸和二氧化锰在加热条件下制备氯气,可用食盐晶体和浓硫酸替代盐酸,为得到干燥的氯化铁,生成的氯气需除去氯化氢、水,可分别通过饱和食盐水、浓硫酸,然后在装置1中反应生成氯化铁,为防止污染空气和氯化铁的水解,1还要连接5装置,以吸收氯气和水,以此解答该题.
解答 解:(1)验室制备无水氯化铁,需要先制取氯气,用2装置,根据题意3用于除去氯气中的氯化氢,4用于干燥氯气,由于无水氯化铁遇潮湿空气极易吸水生成FeCl3•nH2O,所以5防止空气中的水蒸气进入,同时吸收未反应的氯气,防止污染空气,则仪器的连接顺序为d→e→f→g→h→a→b→c,
故答案为:d;e;f;g;h;a;b;c;
(2)实验室用浓盐酸和二氧化锰在加热条件下制备氯气,可用食盐晶体和浓硫酸替代盐酸,装置3用于除去氯化氢,可用饱和食盐水,装置4用于干燥氯气,可用浓硫酸,铁和氯气在装置1中进行反应,5加入碱石灰,可吸收氯气,
故答案为:
| 1 | 2 | 4 | 4 | 5 |
| E | AFG | C | G | I |
故答案为:AlCl3+3H2O?Al(OH)3+3HCl;在装置I后连一干燥装置防空气中水蒸气无水氯化铝反应.
点评 本题考查制备实验方案设计,为高频考点,题目难度中等,侧重于学生的分析、实验能力的考查,明确原理是解题关键,注意把握相关基本实验方法和操作的把握.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
5.下列离子方程式与所述事实相符且正确的是( )
| A. | 用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 稀HNO3溶液与难溶于水的FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | 碳酸氢钙与少量的NaOH溶液反应 Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | Na与水的反应Na+H2O═Na++OH-+H2↑ |
6.现有以下两种有机物:① ②
②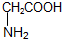 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ②
②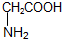 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 有机物①分子中所有原子不可能在同一平面上 | |
| B. | 有机物②与硝基乙烷(CH3CH2NO2)互为同分异构体 | |
| C. | 有机物①与②的核磁共振氢谱具有相同数目的吸收峰 | |
| D. | 有机物①能与浓溴水发生加成反应和取代反应 |
3.已知10.2g A与12.8g B完全反应,生成9.6g C和7.2g D及另一气体E,已知E的密度是H2密度的15.5倍.则气体E在标准状况下的体积( )
| A. | 2.24L | B. | 4.48L | C. | 5.6L | D. | 11.2L |
14.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.2Fe3++2I-═2Fe2++I2 I2+2S2O3═2I-+S4O62-已知:
则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.2Fe3++2I-═2Fe2++I2 I2+2S2O3═2I-+S4O62-已知:
则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”)
11.下列分离或提纯物质的方法正确的是( )
| A. | 用渗析的方法精制Fe(OH)3胶体 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
12. 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
请解释碳酸钙热分解温度最低的原因:碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果.钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低.
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3(用含a和NA的式子表示).
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3(用含a和NA的式子表示).