题目内容
【题目】化学兴趣小组的同学们想要探究锰的性质,进行了下列实验和探究。
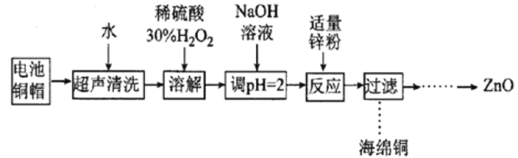
Ⅰ![]() 的制取:在查阅资料后,兴趣小组的同学们设计了以软锰矿石
的制取:在查阅资料后,兴趣小组的同学们设计了以软锰矿石![]() 为原料制取
为原料制取![]() 的步骤,并实验室模拟制备。
的步骤,并实验室模拟制备。
![]()
![]() 已知溶液Ⅰ中Mn为
已知溶液Ⅰ中Mn为![]() 价
价![]()
(1)在“碱熔氧化”时,既可将![]() 与KOH混合物熔融后通入氧气,也可加入
与KOH混合物熔融后通入氧气,也可加入![]() 作为氧化剂。请分析哪种方法更合适并简述理由:________。
作为氧化剂。请分析哪种方法更合适并简述理由:________。
(2)步骤①是________。酸化过程中只需通入过量![]() 即可,请写出对应的离子方程式:_________。
即可,请写出对应的离子方程式:_________。
(3)实际上用这种方法制取![]() 效率很低。若工业上要用此法制取
效率很低。若工业上要用此法制取![]() ,应_______以提高原料的利用率。在实际生产过程中,还可用Ni为阳极、Fe为阴极电解溶液Ⅰ以获得高浓度的
,应_______以提高原料的利用率。在实际生产过程中,还可用Ni为阳极、Fe为阴极电解溶液Ⅰ以获得高浓度的![]() 溶液,试写出阴极的电极反应方程式:_______。
溶液,试写出阴极的电极反应方程式:_______。
Ⅱ![]() 的成分探究:化学实验室存有一瓶开封已久的
的成分探究:化学实验室存有一瓶开封已久的![]() 试剂,化学兴趣小组欲研究该
试剂,化学兴趣小组欲研究该![]() 的纯度。
的纯度。
(1)打开试剂瓶时,有一股气流冲出。甲同学取少量粉末于试管中,加适量蒸馏水振荡,发现固体部分溶解,试管底部沉积有少量黑色不溶物,且溶解过程中管壁发热明显。甲同学查阅资料得知:![]() 变质时有
变质时有![]() 和两种含锰物质生成,且含锰物质中,较高氧化态物质与较低氧化态物质的物质的量之比为
和两种含锰物质生成,且含锰物质中,较高氧化态物质与较低氧化态物质的物质的量之比为![]() 。试写出
。试写出![]() 受热分解的化学方程式:________。
受热分解的化学方程式:________。
为进一步确定![]() 的纯度,乙同学和丙同学先后进行了以下实验;
的纯度,乙同学和丙同学先后进行了以下实验;
①取![]() 样品溶于试管中,过滤,得到黑色固体和滤液1;
样品溶于试管中,过滤,得到黑色固体和滤液1;
②洗涤黑色固体,留取洗涤液,重复三次;
③用分析天平称量黑色固体,其质量为![]() 。
。
(2)据此,乙同学计算得出![]() 的纯度为________
的纯度为________![]() 。
。
在乙同学的实验的基础上,丙同学继续完成了以下实验:
④将②中的洗涤液加入滤液1中,在滤液1中逐滴滴加![]() 溶液,直到灰绿色固体不再增加为止;
溶液,直到灰绿色固体不再增加为止;
⑤过滤,得滤液2,洗涤灰绿色固体并留取洗涤液,重复三次;
⑥将⑤中的洗涤液加入滤液2中,加水标定至![]() ,酸化后用标准液A进行滴定操作,每次取样
,酸化后用标准液A进行滴定操作,每次取样![]() ,总共重复进行了四次滴定实验。
,总共重复进行了四次滴定实验。![]() 提示:
提示:![]()
(3)若步骤④未将②中洗涤液加入滤液1中,会导致最终滴定结果________![]() 填“偏大”“偏小”或“不变”
填“偏大”“偏小”或“不变”![]() 。
。
(4)标准液A可选用下列的________![]() 填字母序号
填字母序号![]() 。
。
a.![]() 溶液 b.
溶液 b.![]() 溶液
溶液
c.![]() 酸性NaI溶液 d.
酸性NaI溶液 d.![]() 酸性
酸性![]() 溶液
溶液
(5)完成所有滴定实验后,最终丙同学计算出![]() 的纯度比乙同学计算所得的数据偏小,请结合上述实验操作分析两位同学实验结果差异较大的原因是______________
的纯度比乙同学计算所得的数据偏小,请结合上述实验操作分析两位同学实验结果差异较大的原因是______________![]() 写2条
写2条![]() 。
。
【答案】氧气氧化合适,不引入杂质 过滤 ![]() 将生成的二氧化锰重新加入碱熔氧化的步骤中
将生成的二氧化锰重新加入碱熔氧化的步骤中 ![]() 10KMnO4
10KMnO4![]() 3K2MnO4+7MnO2+6O2↑+2K2O
3K2MnO4+7MnO2+6O2↑+2K2O ![]() 偏小
偏小 ![]() 实验过程中
实验过程中![]() 部分分解导致滴定结果偏小
部分分解导致滴定结果偏小![]() 洗涤后未干燥黑色物质导致计算结果偏大;滴定操作前进行了两次过滤和洗涤操作,溶液中离子损失较大导致滴定结果偏小
洗涤后未干燥黑色物质导致计算结果偏大;滴定操作前进行了两次过滤和洗涤操作,溶液中离子损失较大导致滴定结果偏小![]()
【解析】
Ⅰ.(1)将![]() 与KOH混合物熔融后通入氧气氧化更合适;
与KOH混合物熔融后通入氧气氧化更合适;
(2)步骤①是过滤,将固液分离;根据氧化还原反应配平方程式;
(3)工业上要用此法制取![]() ,应将生成的二氧化锰重新加入碱熔氧化的步骤中,可以循环利用,以提高原料的利用率;根据电极反应式分析;
,应将生成的二氧化锰重新加入碱熔氧化的步骤中,可以循环利用,以提高原料的利用率;根据电极反应式分析;
Ⅱ.(1)由题意可知,产生的气流,应该是氧气,黑色不溶物且含锰应为二氧化锰,生成的另一含锰物质很可能是锰酸钾,写出化学方程式;
(2)根据物质的量关系进行计算;
(3)若步骤④未将②中洗涤液加入滤液1中,会使得锰酸根离子有损失;
(4)根据反应原理分析解答;
(5)实验过程中![]() 部分分解导致滴定结果偏小或洗涤后未干燥黑色物质导致计算结果偏大或滴定操作前进行了两次过滤和洗涤操作。
部分分解导致滴定结果偏小或洗涤后未干燥黑色物质导致计算结果偏大或滴定操作前进行了两次过滤和洗涤操作。
Ⅰ.(1)将![]() 与KOH混合物熔融后通入氧气氧化更合适,不引入杂质;
与KOH混合物熔融后通入氧气氧化更合适,不引入杂质;
故答案为:氧气氧化合适,不引入杂质;
(2)步骤①是过滤,将固液分离;溶液Ⅰ中Mn为![]() 价,则为锰酸根离子,酸化过程中通入过量
价,则为锰酸根离子,酸化过程中通入过量![]() 生成高锰酸根离子,二氧化锰沉淀和碳酸氢根离子,离子方程式为
生成高锰酸根离子,二氧化锰沉淀和碳酸氢根离子,离子方程式为![]() ;
;
故答案为:过滤;![]() ;
;
(3)工业上要用此法制取![]() ,应将生成的二氧化锰重新加入碱熔氧化的步骤中,可以循环利用,以提高原料的利用率;用Ni为阳极、Fe为阴极电解溶液Ⅰ以获得高浓度的
,应将生成的二氧化锰重新加入碱熔氧化的步骤中,可以循环利用,以提高原料的利用率;用Ni为阳极、Fe为阴极电解溶液Ⅰ以获得高浓度的![]() 溶液,阴极被还原,而Fe作为阴极,该电极反应方程式为,水得到电子,
溶液,阴极被还原,而Fe作为阴极,该电极反应方程式为,水得到电子,![]() ;
;
故答案为:将生成的二氧化锰重新加入碱熔氧化的步骤中;![]() ;
;
Ⅱ.(1)由题意可知,产生的气流,应该是氧气,黑色不溶物且含锰应为二氧化锰,生成的另一含锰物质很可能是锰酸钾,较高氧化态锰酸钾与较低氧化态二氧化锰的物质的量之比为![]() ,根据化学方程式书写原则,得出
,根据化学方程式书写原则,得出![]() 在受热分解的化学方程式:10KMnO4
在受热分解的化学方程式:10KMnO4![]() 3K2MnO4+7MnO2+6O2↑+2K2O;
3K2MnO4+7MnO2+6O2↑+2K2O;
故答案为:10KMnO4![]() 3K2MnO4+7MnO2+6O2↑+2K2O;
3K2MnO4+7MnO2+6O2↑+2K2O;
(2)由上题可知![]() 变质后产生的固体杂质为
变质后产生的固体杂质为![]() 、
、![]() 、
、![]() ,
,
过滤洗涤后黑色固体为二氧化锰,根据![]()
609 188 591
得到10g样品中杂质的质量![]() ,
,![]() ;
;
故答案为:![]() ;
;
(3)若步骤④未将②中洗涤液加入滤液1中,会使得锰酸根离子有损失,用![]() 溶液滴定时,会导致最终滴定结果偏小;
溶液滴定时,会导致最终滴定结果偏小;
故答案为:偏小;
(4)![]() 不与
不与![]() 反应,不可选;
反应,不可选;
![]() 与
与![]() 反应,现象明显便于观察,且浓度也合适,可选;
反应,现象明显便于观察,且浓度也合适,可选;
![]() 酸性NaI溶液与
酸性NaI溶液与![]() 反应生成
反应生成![]() 为紫黑色,干扰颜色观察,且浓度过大,不可选;
为紫黑色,干扰颜色观察,且浓度过大,不可选;
![]() 浓度过大,不可选;
浓度过大,不可选;
故答案为:b;
(5)实验过程中![]() 部分分解导致滴定结果偏小或洗涤后未干燥黑色物质导致计算结果偏大或滴定操作前进行了两次过滤和洗涤操作,溶液中离子损失较大导致滴定结果偏小;
部分分解导致滴定结果偏小或洗涤后未干燥黑色物质导致计算结果偏大或滴定操作前进行了两次过滤和洗涤操作,溶液中离子损失较大导致滴定结果偏小;
故答案为:实验过程中![]() 部分分解导致滴定结果偏小
部分分解导致滴定结果偏小![]() 洗涤后未干燥黑色物质导致计算结果偏大;滴定操作前进行了两次过滤和洗涤操作,溶液中离子损失较大导致滴定结果偏小
洗涤后未干燥黑色物质导致计算结果偏大;滴定操作前进行了两次过滤和洗涤操作,溶液中离子损失较大导致滴定结果偏小![]() 。
。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________