题目内容
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________
【答案】64 +247.3 温度超过250℃时,催化剂的催化效率降低 增大反应压强或增大CO2的浓度 a CO2 + Li4SiO4 ![]() Li2CO3 + Li2SiO3 CO2 + 2e- =CO+O2 -
Li2CO3 + Li2SiO3 CO2 + 2e- =CO+O2 -
【解析】
(1)建立三步走思维:

![]()
x = 4
①此温度下该反应的平衡常数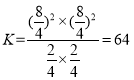
故答案为64;
②已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
②CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
将①+②×2 - ③×2,反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =+247.3 kJ·mol-1
2CO(g)+2H2(g) 的△H =+247.3 kJ·mol-1
故答案为+247.3;
⑵以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①250~300℃时,根据图中信息知道高于250℃时,催化剂的催化效率降低,因此温度升高而乙酸的生成速率降低,故答案为温度超过250℃时,催化剂的催化效率降低;
②为了提高该反应中CH4的转化率,可以采取的措施是增大压强或者增加二氧化碳的浓度,
故答案为增大反应压强或增大CO2的浓度;
⑶Li2O、Na2O、MgO均能吸收CO2 ;
①a选项,可在具有强氧化性的物质中寻找,强氧化性的物质不与二氧化碳反应,故a不合理;
b选项,碱性氧化物与二氧化碳反应,故b合理;
c选项,可在ⅠA、ⅡA族元素形成的氧化物主要是碱性氧化物,与二氧化碳反应,故c合理;
综上所述,答案为a;
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3,根据质量守恒,另一中生成物为Li2SiO3,平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2 + Li4SiO4 ![]() Li2CO3 + Li2SiO3,
Li2CO3 + Li2SiO3,
故答案为CO2 + Li4SiO4 ![]() Li2CO3 + Li2SiO3;
Li2CO3 + Li2SiO3;
⑷根据分析CO2在电极a放电变为CO,化合价降低,得到电子,因此其电极反应式是CO2 + 2e-=CO+O2-,
故答案为CO2 + 2e-=CO+O2-。

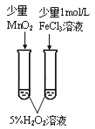
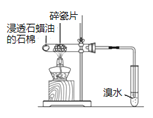
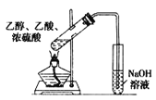
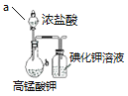
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
目的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 制备乙酸乙酯 | 比较Cl2、I2的氧化性 |
A.AB.BC.CD.D