题目内容
【题目】关于下列装置说法正确的是( ) 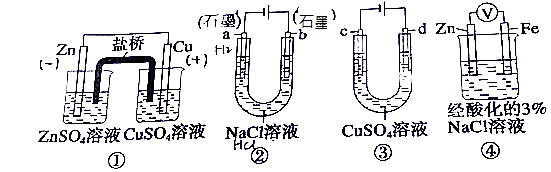
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段后,a极附近的溶液pH增大,滴加酚酞为红色
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,加入K3[Fe(CN)6]溶液产生蓝色沉淀
【答案】B
【解析】解:A.装置①为原电池,Zn为负极,原电池中阳离子向正极移动,则盐桥中的K+移向CuSO4溶液,故A错误;
B.装置②为电解池,a为阴极,氢离子在阴极得到电子,则a极附近生成碱,溶液pH增大,滴加酚酞为红色,故B正确;
C.精炼铜时,粗铜为阳极,d与正极相连为阳极,则d极为粗铜、c极为纯铜,故C错误;
D.装置④为原电池,Zn作负极,Fe不能失去电子,电子由负极Zn流向正极Fe,而K3[Fe(CN)6]溶液与亚铁离子反应产生蓝色沉淀,该装置不会出现蓝色沉淀,故D错误;
故选B.
A.装置①为原电池,Zn为负极,原电池中阳离子向正极移动;
B.装置②为电解池,a为阴极,氢离子在阴极得到电子;
C.精炼铜时,粗铜为阳极,d与正极相连为阳极;
D.装置④为原电池,Zn作负极,Fe不能失去电子.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目