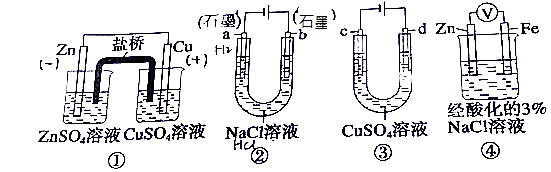
题目内容
【题目】下列化学用语对事实的表述不正确的是
A. 钠与水反应的离子方程式:2Na+2H2O==2Na++2OH-+H2↑
B. 用惰性电极电解硝酸银溶液的离子方程式:4Ag++2H2O![]() 4Ag+O2↑+4H+
4Ag+O2↑+4H+
C. 电解精炼铜的阴极反应式:Cu2++2e-=Cu
D. 苯乙烯聚合反应的化学方程式: 
【答案】D
【解析】分析:A. 二者反应生成氢氧化钠和氢气;
B. 惰性电极电解时,银离子及水中的氢氧根离子放电;
C. 金属铜的电解精炼过程中阴极上铜离子得电子;
D.苯乙烯发生加聚反应生成聚苯乙烯。
详解:A. 钠与水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B. 用惰性电极电解硝酸银溶液的离子反应为4Ag++2H2O![]() 4Ag+O2↑+4H+,故B正确;
4Ag+O2↑+4H+,故B正确;
C. 金属铜的电解精炼过程中,阴极上铜离子得电子生成Cu,其电极反应式为:Cu2++2e-=Cu,故C正确;
D. 苯乙烯发生加聚反应生成聚苯乙烯,正确的化学方程式为: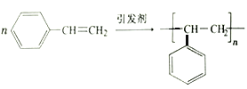 ,所以D选项是错误的;
,所以D选项是错误的;
所以本题选D。

【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。

若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。
【题目】利用化学反应可以为人类提供能源,也可用来解决环境问题。
(1)已知某些化学键的键能数据如下:
化学键 | H-H | O=O | O-H |
键能kJ·mol-1 | 436 | 495 | 463 |
①写出H2与O2反应生成水蒸气的热化学方程式____________;
②利用该反应设计成燃料电池,已知该电池每发1kW·h电能生成360g水蒸气,则该电池的能量转化率为_____%(结果保留三位有效数字)。
(2)三室式电渗析法可以处理含K2SO4的废水,原理如图所示,两极均为惰性电极,ab为阳离子交换膜,cd为阴离子交换膜。

①阴极区的pH______(填“升高”或“降低”);
②阳极发生的电极反应式为__________;
③当电路中通过1mol电子的电量时,阴极上生成气体的体积为_____L(标准状况)。