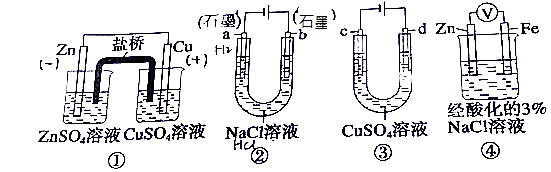
题目内容
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为.
(2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如: ①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2= .
(3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)N2(g)+2CO2(g)△H<0 在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.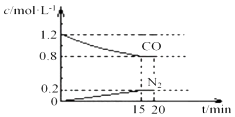
①0~15min 内,v(CO2)= , 25℃时该反应平衡常数为(该空保留2位小数);
②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是(填选项序号).
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3 . 已知NaHSO3溶液同时存在以下两种平衡: ①HSO3﹣SO32﹣+H+ , ②HSO3﹣+H2OH2SO3+OH﹣;常温下,0.1 mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)c(SO32﹣)(填“>”、“=”或“<”).
【答案】
(1)CO(g)+ ![]() SO2(g)=
SO2(g)= ![]() S(s)+CO2(g)△H=﹣135kJ/mol
S(s)+CO2(g)△H=﹣135kJ/mol
(2)﹣1160KJ/mol
(3)0.027 mol?L﹣1?min﹣1;0.14; a
(4)<
【解析】解:(1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,因此反应的热化学方程式为:CO(g)+ ![]() SO2(g)=
SO2(g)= ![]() S(s)+CO2(g)△H=﹣135kJ/mol,所以答案是:CO(g)+
S(s)+CO2(g)△H=﹣135kJ/mol,所以答案是:CO(g)+ ![]() SO2(g)=
SO2(g)= ![]() S(s)+CO2(g)△H=﹣135kJ/mol;(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574KJmol﹣1
S(s)+CO2(g)△H=﹣135kJ/mol;(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574KJmol﹣1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)× ![]() 可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867KJmol﹣1,则(﹣574KJmol﹣1+△H2)×
可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867KJmol﹣1,则(﹣574KJmol﹣1+△H2)× ![]() =﹣867KJmol﹣1,
=﹣867KJmol﹣1,
解得△H2=﹣1160KJ/mol,
所以答案是:﹣1160KJ/mol;(3)①v(CO)= ![]() =
= ![]() =0.027 molL﹣1min﹣1;所以v(CO2)=v(CO)=0.027 molL﹣1min﹣1;
=0.027 molL﹣1min﹣1;所以v(CO2)=v(CO)=0.027 molL﹣1min﹣1;
2NO(g)+ | 2CO(g) | N2(g)+ | 2CO2(g) | |
起始 | 1 | 1.2 | 0 | 0 |
转化 | 0.4 | 0.4 | 0.4 | 0.4 |
平衡 | 0.6 | 0.8 | 0.4 | 0.4 |
所以K= ![]() =0.14,所以答案是:0.027 molL﹣1min﹣1; 0.14;
=0.14,所以答案是:0.027 molL﹣1min﹣1; 0.14;
②a.升高温度平衡逆向移动,导致NO浓度增加,故符合; b.增加CO的量,平衡正向移动,导致NO浓度下降,故不符合; c.降低温度,平衡正向移动,导致NO浓度下降,故不符合; d.扩大容积平衡逆向移动,但导致NO浓度下降,故不符合;故选:a;(4)已知NaHSO3中的HSO3﹣既能电离又能水解:HSO3﹣H++SO32﹣电离显酸性,HSO3﹣+H2OH2SO3 +OH﹣ 水解显碱性;常温下,0.1molL﹣1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32﹣)>c(H2SO3),所以答案是:<.

 阅读快车系列答案
阅读快车系列答案【题目】下表是A、B、C三种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②填充模型为: |
B | ①可以从煤干馏生成的煤焦油中提取;②填充模型为: |
C | ①工业生产中可通过A与H2O加成获得;②相对分子质量为46 |
请结合信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的反应类型为______。
(2)B与浓硝酸发生反应的化学方程式为________________。
(3)写出C的同分异构体______________。
(4)①C与乙酸可反应生成酯,其化学方程式为______;
②反应装置如图,a试管中碎瓷片的作用是_______;试管b中的试剂是_______。

【题目】碳酸亚铁(白色固体,难溶于水)是种重要的工业原料,可用于制备补血剂乳酸亚铁。某研究小组 通过下列实验,寻找利用复分解反应制各FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNa2CO3溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,后出现明显的红褐色 |
0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅱ: 产生白色沉淀及少量无色气泡,2min,后出现明显的灰绿色 | |
0.8mol/L(NH4)2Fe(SO4)2溶液(pH=4.0) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅲ: 产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中产生HCO3-和红褐色沉淀的离子方程式为___________
(2)实验Ⅱ中产生FeCO3的离子方程式为___________
(3)为了探究实验Ⅲ中NH4+所起的作用,甲同学设计了实验Ⅳ进行探究:
操作 | 现象 | |
实验Ⅳ | 向0.8mol/LFeSO4溶液中加入_____,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL1mol/LNaHCO3溶液混合 | 与实验Ⅲ现象相同 |
实验Ⅳ中加入Na2SO4固体的目的是_____
对比实验Ⅱ、Ⅲ、Ⅳ,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是_____.再取该溶液一滴管2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验Ⅲ中FeCO3的纯度最高。需要利用如图所示的装置进行定量测定。

分别将实验Ⅰ、Ⅱ、Ⅲ中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。反应完成后通入N2的作用是_______。为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是_________
(5)实验反思:经测定,实验Ⅲ中的FeCO3纯度高于实验Ⅰ和实验Ⅱ。通过以上实验分析。制备FeCO3实验成功的关键因素是__________.