题目内容
【题目】碳酸锰(MnCO3)是高性能磁性材料,金属钨是重要的战略物资。由黑钨矿(主要成分为FeWO4、MnWO4,少量SiO2)制取碳酸锰和金属钨的流程如下:

已知:①钨酸(H2WO4)酸性很弱,难溶于水,其钠盐易溶于水。②SiO32-和WO42-完全沉淀的pH分别为8、5。③草酸(H2C2O4)具有酸性和还原性,能分解。
回答下列问题:
(1)将矿石粉碎的目的是_____________________。
(2)固体(X)的化学式是____________________________。
(3)写出高温焙烧过程中,MnWO4发生反应的化学方程式________________。
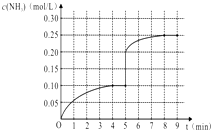
(4)MnO2与硫酸、草酸反应的离子方程式是__________________________。测得一定量MnO2完全溶解的时间与温度的关系如图所示,分析控温加热75℃时MnO2溶解所需时间最少的原因__________________。

(5)滤液Ⅱ调节pH应选择的试剂为_________________。
A.WO3 B.氨水 C.稀盐酸 D.NaHCO3
(6)用Na2CO3溶液沉淀Mn2+时,应控制MnSO4溶液的pH不超过8,防止生成Mn(OH)2,用Na2CO3溶液沉锰采取的操作方法是________________________。
【答案】 加快反应速率,提高原料的利用率; Fe2O3 2MnWO4+2Na2CO3+O2=2Na2WO4+2MnO2+2CO2 MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O 75℃以前,温度升高,反应速率加快,所需时间减少;75℃以后,部分草酸分
解,导致浓度降低,速率下降,所需时间增多。 C 向硫酸锰溶液中缓慢滴加碳酸钠溶液,边滴边搅拌
。
【解析】(1)将矿石粉碎的目的是加快反应速率,提高原料的利用率;正确答案:加快反应速率,提高原料的利用率。
(2)黑钨矿(主要成分为FeWO4、MnWO4,少量SiO2),从整个流程看出,滤液1进行的一系列操作中,最终产生的金属钨;滤渣1进行处理后,加入盐酸过滤后,得到二氧化锰,那么滤液中含有铁元素,滤液中的铁元素最终加热、蒸干、灼烧后,可以得到氧化铁固体;所以固体(X)的化学式是Fe2O3。正确答案: Fe2O3。
(3)高温条件下,MnWO4与Na2CO3、O2共同反应生成Na2WO4、MnO2和CO2;反应的化学方程式:2MnWO4+2Na2CO3+O2=2Na2WO4+2MnO2+2CO2;正确答案:2MnWO4+2Na2CO3+O2=2Na2WO4+2MnO2+2CO2;
(4)MnO2具有氧化性,在酸性条件下,能够把草酸氧化为二氧化碳,反应的离子方程式是:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O;已知草酸(H2C2O4)具有酸性和还原性,能分解;根据图像可知:75℃以前,温度升高,反应速率加快,所需时间减少;75℃以后,部分草酸分解,导致浓度降低,速率下降,所需时间增多;正确答案:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O;75℃以前,温度升高,反应速率加快,所需时间减少;75℃以后,部分草酸分解,导致浓度降低,速率下降,所需时间增多。
(5)根据信息:①钨酸(H2WO4)酸性很弱,难溶于水,其钠盐易溶于水。②SiO32-和WO42-完全沉淀的pH分别为8、5可知,加入盐酸调节溶液的pH,先使SiO32-变为硅酸沉淀,然后再使WO42-变为H2WO4沉淀;正确答案:C。
(6) 因Na2CO3溶液水解显碱性,如果溶液的碱性太强,易生成Mn(OH)2沉淀,所以应控制MnSO4溶液的pH不超过8;用Na2CO3溶液沉锰采取的操作方法是:向硫酸锰溶液中缓慢滴加碳酸钠溶液,边滴边搅拌;正确答案:向硫酸锰溶液中缓慢滴加碳酸钠溶液,边滴边搅拌。

【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)