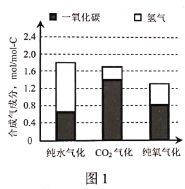
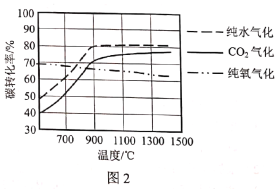
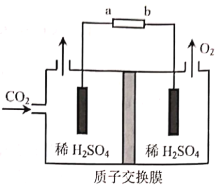
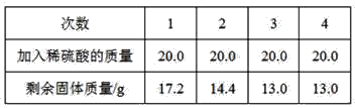
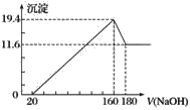
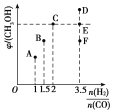
题目内容
【题目】铁及其化合物在生产生活中有广泛应用。
(1)![]() 可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向![]() 的铁屑中通入
的铁屑中通入![]() 生产无水
生产无水![]() 。已知:
。已知:![]() 固体呈黑棕色、易潮解、
固体呈黑棕色、易潮解、![]() 左右时升华。
左右时升华。
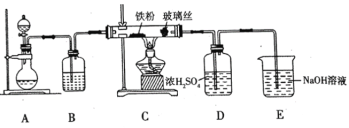
回答下列问题
①写出用高锰酸钾和浓盐酸在装置![]() 中制备氯气的离子方程式_____。
中制备氯气的离子方程式_____。
②装置![]() 中加入的试剂是_____,装置
中加入的试剂是_____,装置![]() 中玻璃丝的作用是_____,
中玻璃丝的作用是_____,![]() 中
中![]() 溶液的作用是_____。
溶液的作用是_____。
③有同学认为气体通入装置![]() 前应除去其中含有的
前应除去其中含有的![]() ,改进措施为_____。
,改进措施为_____。
(2)一种新型高效净水剂![]() (聚合氯化铁铝
(聚合氯化铁铝![]() ,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取![]() ,设计生产流程如下:
,设计生产流程如下:
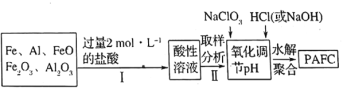
①实验室现需用![]() 的稀盐酸,欲用
的稀盐酸,欲用![]() 的浓盐酸配制,则所需浓盐酸体积为________。
的浓盐酸配制,则所需浓盐酸体积为________。
②![]() 中
中![]() 显________价,
显________价,![]() 在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中![]() 与
与![]() 的含量比 B.测定原料是否完全溶解
的含量比 B.测定原料是否完全溶解
C.测定溶液中![]() 的含量,以确定加入
的含量,以确定加入![]() 的量 D.测定溶液中
的量 D.测定溶液中![]() 的含量
的含量
【答案】![]() 浓硫酸 防止堵塞导管 除去过量氯气,防止其污染空气 在装置A、B之间连接盛有饱和食盐水的洗气瓶 50mL +3 不能 C
浓硫酸 防止堵塞导管 除去过量氯气,防止其污染空气 在装置A、B之间连接盛有饱和食盐水的洗气瓶 50mL +3 不能 C
【解析】
(1)根据题干信息可知实验目的为制备无水FeCl3,装置A为制备Cl2的装置,装置B为气体的干燥装置,C装置为Cl2和铁屑在500-600℃时反应生成FeCl3,D装置中的浓硫酸可吸收水蒸气,防止E中的水蒸气进入C装置中,E为尾气处理装置,据此分析解答;
(2)结合溶液稀释的规律进行相关计算,根据生产流程分析可知,工业生产废料加入过量的盐酸溶解后生成Fe2+、Fe3+和Al3+,取样分析后加入NaClO3将Fe2+氧化为Fe3+,加入HCl(或NaOH)调节pH水解聚合得到PAFC,据此分析解答。
(1)①装置A用高锰酸钾和浓盐酸制备氯气时,HCl被氧化为Cl2,高锰酸钾被还原为MnCl2,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
②装置B为气体的干燥装置,Cl2为酸性气体,可用浓硫酸干燥,由于FeCl3在100℃左右时升华,则装置C中玻璃丝的作用为防止堵塞导管,E为尾气处理装置,NaOH可吸收过量的Cl2,防止其污染空气,故答案为:浓硫酸;防止堵塞导管;除去过量氯气,防止其污染空气;
③浓盐酸易挥发,生成的Cl2中混有挥发的HCl气体,热铁屑与HCl反应会生成无水FeCl2,使得制备的无水FeCl3不纯,因此可在装置A、B之间连接盛有饱和食盐水的洗气瓶,除去Cl2中含有的HCl气体,故答案为:装置A、B之间连接盛有饱和食盐水的洗气瓶;
(2)①根据公式c稀×V稀=c浓×V浓可得,c稀HCl×V稀HCl=c浓HCl×V浓HCl,由于实验室中没有200mL的容量瓶,因此选用250mL的容量瓶配制2mol/L的稀盐酸,则![]() ,故答案为:50mL;
,故答案为:50mL;
②由上述分析可知,NaClO3将Fe2+氧化为Fe3+,加入HCl(或NaOH)调节pH水解聚合得到PAFC,因此PAFC中Fe显+3价,PAFC在强酸性或强碱性溶液中均不能稳定存在,故答案为:+3;不能;
③在氧化之前,可测定溶液中Fe2+的含量,以确定加入NaClO3的量,C选项符合题意,故答案为:C。

【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
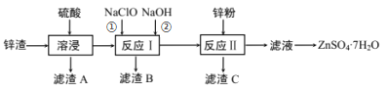
(1)“溶浸”操作中,写出加快“锌渣”“溶浸”速率的两种措施_____________。
(2)“滤渣A”的主要成分是________;“滤渣C”的主要成分是________。
(3)“反应Ⅰ”中①,先加入NaClO反应的离子方程式为____________;“反应Ⅰ”中②,再加入NaOH调节溶液pH约为_________,则滤液中Fe元素浓度小于4×105mol·L-1,而基本存在于“滤渣B”中。(Ksp[Fe(OH)3]=4×1038)
(4)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(5)在实验室中,由滤液获得ZnSO4·7H2O晶体的具体实验操作有_____________。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O