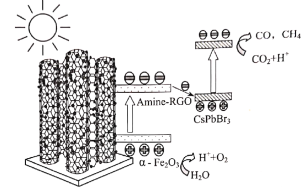
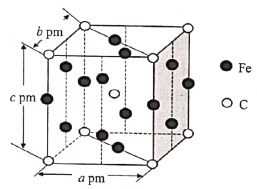
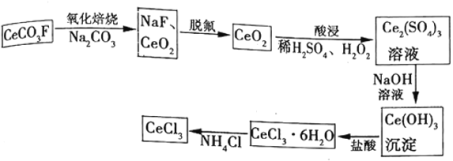
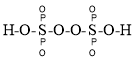题目内容
【题目】煤炭气化作为洁净煤利用的核心技术,是影响煤化工系统效率、污染物及温室气体排放的关键。工业生产中主要的气化方式包括纯水气化、CO2气化和纯氧气化,反应如下:
i.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+119kJ·mol-1
CO(g)+H2(g) ΔH=+119kJ·mol-1
ii.C(s)+CO2(g)![]() 2CO(g) ΔH=+162kJ·mol-1
2CO(g) ΔH=+162kJ·mol-1
iii.C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH=-123kJ·mol-1
CO(g) ΔH=-123kJ·mol-1
iv.C(s)+ O2(g)![]() CO2(g) ΔH=-409kJ·mol-1
CO2(g) ΔH=-409kJ·mol-1
(1)均相水煤气反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的ΔH__。
H2(g)+CO2(g)的ΔH__。
(2)图1是不同气化方式得到的合成气成分,图2是温度对碳转化率的影响(碳转化率是指气化得到气体中的碳占入炉原料煤中碳的质量分数)。
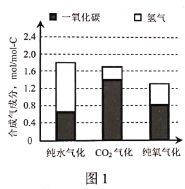
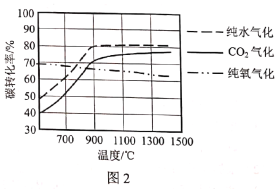
①气化过程中不同氧化剂的配比会对合成气的成分造成很大影响,为了提高合成气的氢碳比,生产中应该适当提高__在氧化剂中的比例。
②若使用混合氧化剂进行气化,最佳气化温度是___℃。温度升高纯氧气化的碳转化率降低,原因是___。
③工业上常在压强200kPa的条件下进行气化,压强过高过低都不利于气化的进行,可能的原因是__。
④T℃时,向容积可变的恒压密闭容器中加入20g燃煤(含碳84%)和2molH2O(g)模拟纯水气化反应,起始容积为2L。一段时间达到平衡后,测得容器内H2为1mol。则该温度下C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数K=__。
CO(g)+H2(g)的平衡常数K=__。
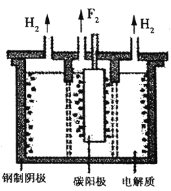
(3)煤的气化中可以利用CO2捕集技术实现CO2的综合利用。用石墨电极电解CO2制CH3CH2OH的原理示意图如图:
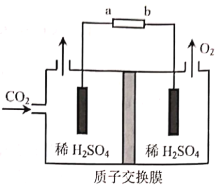
①b为电源的___(填“正”或“负”)极。
②生成CH3CH2OH的电极反应式为___。
【答案】-43kJ·mol-1 水 900 纯氧气化涉及的反应ⅲ、反应ⅳ都是放热反应,温度升高,平衡逆移,碳转化率降低 压强高会使气化反应ⅰ、ⅱ、ⅲ的平衡逆向移动;压强低反应速率小,都不利于气化的进行 ![]() mol·L-1 正 2CO2+12H++12e-=CH3CH2OH+3H2O
mol·L-1 正 2CO2+12H++12e-=CH3CH2OH+3H2O
【解析】
(1)根据盖斯定律进行计算;
(2)据图可知,纯水气化时氢碳比最大,CO2气化氢碳比最小;温度升高纯氧气化中碳转化率略微减小,而纯水气化和CO2气化碳转化率增大,温度高于900℃后升高不明显;
④恒压容器中气体的体积比等于气体的物质的量之比,据此先计算平衡时容器的体积,再根据K=![]() 计算平衡常数;
计算平衡常数;
(3)该装置目的是用石墨电极电解CO2制CH3CH2OH,C元素化合价降低被还原,所以通入二氧化碳的一极为电解池的阴极,则产生氧气的一极为阳极。
(1)已知:i.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+119kJ·mol-1
CO(g)+H2(g) ΔH=+119kJ·mol-1
ii.C(s)+CO2(g)![]() 2CO(g) ΔH=+162kJ·mol-1
2CO(g) ΔH=+162kJ·mol-1
根据盖斯定律i-ii可得反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的ΔH=+119kJ·mol-1-(+162kJ·mol-1)=-43kJ·mol-1;
H2(g)+CO2(g)的ΔH=+119kJ·mol-1-(+162kJ·mol-1)=-43kJ·mol-1;
(2)①据图可知纯水气化时氢碳比最大,所以为了提高合成气氢碳比凯越适当提高水在氧化剂中的比例;
②据图可知温度升高,纯氧气化碳转化率略微减小,而纯水气化和CO2气化碳转化率增大,温度高于900℃后升高不明显,所以为了提高碳转化率,同时尽量降低能耗,提高反应速率,最佳的气化温度应为900℃;纯氧气化涉及的反应ⅲ、反应ⅳ都是放热反应,温度升高,平衡逆移,所以温度升高碳转化率降低;
③压强高会使气化反应ⅰ、ⅱ、ⅲ的平衡逆向移动,压强低反应速率小,都不利于气化的进行,所以压强不能过高也不能过低;
④该反应的平衡常数K的表达式为![]() ,平衡时容器内n(H2)=1mol,根据反应方程式可知该时段内消耗n(H2O)=1mol,生成的n(CO)=1mol,剩余的n(H2O)=2mol-1mol=1mol,所以平衡时容器内气体总物质的量为1mol+1mol+1mol=3mol,压强不变,则体积比等于气体的物质的量之比,初始气体的物质的量为2mol,平衡时为3mol,容器初始体积为2L,所以平衡容器体积为3L,则平衡时容器内c(H2O)= c(H2)=c(CO)=
,平衡时容器内n(H2)=1mol,根据反应方程式可知该时段内消耗n(H2O)=1mol,生成的n(CO)=1mol,剩余的n(H2O)=2mol-1mol=1mol,所以平衡时容器内气体总物质的量为1mol+1mol+1mol=3mol,压强不变,则体积比等于气体的物质的量之比,初始气体的物质的量为2mol,平衡时为3mol,容器初始体积为2L,所以平衡容器体积为3L,则平衡时容器内c(H2O)= c(H2)=c(CO)=![]() mol/L,K=
mol/L,K=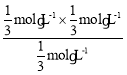 =
=![]() mol·L-1;
mol·L-1;
(3)①根据分析产生氧气的一极为电极池的阳极,阳极与外接电源的正极相连,所以b为电源的正极;
②二氧化碳被还原生成乙醇,电解质溶液显酸性,所以电极反应式为2CO2+12H++12e-=CH3CH2OH+3H2O。

 计算高手系列答案
计算高手系列答案【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。