题目内容
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
【答案】B
【解析】
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJmol-1,故A错误;
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,由于钡离子与硫酸根离子生成硫酸钡的反应为放热反应,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1,故B正确;
BaSO4(s)+H2O(l) △H < -57.3kJmol-1,故B正确;
C. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,由于该反应为可逆反应,则平衡时消耗氮气的物质的量小于0.5mol,即1mol氮气与氢气完全反应放出热量大于38.6kJ,则正确的热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H <-38.6kJmol-1,故C错误;
2NH3(g) △H <-38.6kJmol-1,故C错误;
D. ①4Al(s)+3O2(g)=2A12O3,△H=-2834.9kJmol-1②4Al(s)+2O3(g)=2A12O3,△H=-3119.1gkJmol-1,根据盖斯定律①-②可得:302(g)=203(g)△H=-2834.9kJmol-1-(-3119.1kJmol-1)=+284.2kJmol-1,该反应为吸热反应,说明氧气的能量小于臭氧,则氧气比臭氧稳定,故D错误;
答案选B。

【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
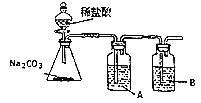
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。