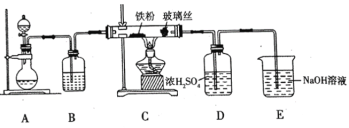
题目内容
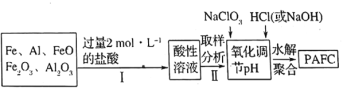
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
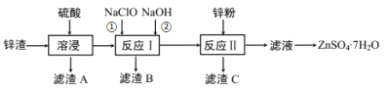
(1)“溶浸”操作中,写出加快“锌渣”“溶浸”速率的两种措施_____________。
(2)“滤渣A”的主要成分是________;“滤渣C”的主要成分是________。
(3)“反应Ⅰ”中①,先加入NaClO反应的离子方程式为____________;“反应Ⅰ”中②,再加入NaOH调节溶液pH约为_________,则滤液中Fe元素浓度小于4×105mol·L-1,而基本存在于“滤渣B”中。(Ksp[Fe(OH)3]=4×1038)
(4)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(5)在实验室中,由滤液获得ZnSO4·7H2O晶体的具体实验操作有_____________。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O
【答案】锌渣粉碎成粉末、适当提高温度、适当提高硫酸浓度、搅拌 PbSO4 Cu、(Zn) 2Fe2++ClO+2H+=2Fe3++Cl+H2O 3 除去锌粉表面的氧化膜 蒸发浓缩、冷却结晶、过滤洗涤 C
【解析】
氧化锌矿(主要成分为ZnO、FeO、CuO、PbO等)加稀硫酸溶解,过滤,滤渣A为难溶物硫酸铅,滤液中主要含有硫酸锌、硫酸铜、硫酸亚铁等;加NaClO氧化亚铁离子,加NaOH溶液生成氢氧化铁沉淀,过滤;此时滤液中含有硫酸铜、硫酸锌和硫酸钠,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液主要为硫酸锌和硫酸钠,经蒸发浓缩、冷却结晶、过滤洗涤得到ZnSO47H2O晶体,以此解答该题。
(1)锌渣粉碎成粉末、适当提高温度、适当提高硫酸浓度、搅拌等措施都可以加快“锌渣”“溶浸”速率;
(2)滤渣A为难溶物PbSO4;滤渣C为被置换出来的铜和过量的锌;
(3)“反应Ⅰ”中①,加入NaClO氧化亚铁离子生成铁离子,自身被还原成氯离子,根据电子守恒和元素守恒可得离子方程式为2Fe2++ClO+2H+=2Fe3++Cl+H2O;Ksp[Fe(OH)3]=c(Fe3+)·c3(OH),当c(Fe3+)=4×105mol·L-1时,c(OH)=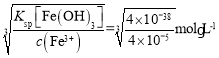 =10-11mol/L,所以溶液的pH值为3;
=10-11mol/L,所以溶液的pH值为3;
(4)锌粉为活泼金属,容易被空气氧化,形成氧化膜,稀硫酸可以除去锌粉表面的氧化膜;
(5)从溶液中获取晶体,一般需要经过蒸发浓缩、冷却结晶、过滤洗涤等步骤;
(6)28.70 g ZnSO47H2O的物质的量为0.1mol,由Zn元素守恒可知,可以生成0.1molZnSO4H2O或ZnSO4或ZnO,或![]() molZn3O(SO4)2;
molZn3O(SO4)2;
若得ZnSO4H2O的质量为17.90g(100℃);
若得ZnSO4的质量为16.10g(250℃);
若得Zn3O(SO4)2的质量约为13.43g(680℃);
若得ZnO的质量为8.10g(930℃);
综上所述答案为C。