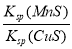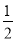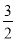题目内容
氨的催化氧化过程主要有以下两个反应:
(ⅰ)4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.5 kJ·mol-1
(ⅱ)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1267 kJ·mol-1
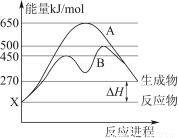
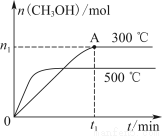
测得温度对NO、N2产率的影响如图所示。下列说法错误的是( )
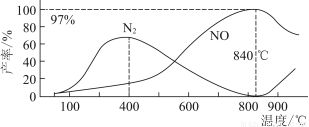
A.升高温度,反应(ⅰ)和(ⅱ)的平衡常数均减小
B.840 ℃后升高温度,反应(ⅰ)的正反应速率减小,反应(ⅱ)的正反应速率增大
C.900 ℃后,NO产率下降的主要原因是反应(ⅰ)平衡逆向移动
D.800 ℃左右时,氨的催化氧化主要按照(ⅰ)进行
B
【解析】升高温度,两个反应的反应速率均增大,B项错误;两反应均为放热反应,升高温度平衡均逆向移动,平衡常数均减小,A项正确;由图像看出,900 ℃后,温度越高,NO产率越小,说明随温度升高平衡逆向移动,C项正确;800 ℃左右时,NO的产率最高,而N2的产率最低,D项正确

常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验编号 | HA的物质的 量浓度(mol·L-1) | NaOH的物质的 量浓度(mol·L-1) | 混合后溶 液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.两者相等D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)= mol·L-1。