题目内容
11.漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为HClO2-→ClO2↑+H++Cl-+H2O(未配平).在该反应中,当有1mol ClO2生成时转移的电子个数约为6.02×1023.分析 由HClO2-→ClO2↑+H++Cl-+H2O可知,Cl元素的化合价由+3价降低为-1价,由+3价升高为+4价,结合化合价变化计算转移电子.
解答 解:由HClO2→ClO2↑+H++Cl-+H2O可知,反应物中Cl元素的化合价既升高又降低,当有1molClO2生成时,转移的电子数为1mol×(4-3)×NAmol-1=NA≈6.02×1023,故答案为:6.02×1023.
点评 本题考查氧化还原反应中转移电子的计算,为高频考点,把握反应中元素的化合价变化计算转移电子数为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
2.下列物质中既能与盐酸反应又能与NaOH溶液反应,且都不产生气体的是( )
| A. | NH4HCO3 | B. | Na2SiO3 | C. | Na2CO3 | D. | Al2O3 |
19.下列溶液一定呈中性的是( )
| A. | 室温时将pH=5的盐酸稀释100倍所得到的溶液 | |
| B. | 等物质的量的强酸和强碱反应后所得到的混合溶液 | |
| C. | 氢氧化钠溶液与醋酸溶液混合后c(Na+)=c(CH3COO-)的溶液 | |
| D. | 硝酸铵溶于水得到的溶液 |
6.下列反应的离子方程式正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 铜丝在氯气中燃烧:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$Cu2++2Cl- | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O | |
| D. | 氯化铁溶液腐蚀铜箔制印刷线路板:Fe3++Cu=Fe2++Cu2+ |
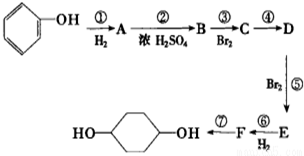 已知实验室由
已知实验室由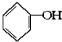 合成
合成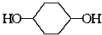 的反应流程如图(部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)请回答下列问题:
的反应流程如图(部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)请回答下列问题: 、D
、D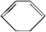 .
.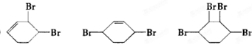 (其中一种).(写出一种即可)
(其中一种).(写出一种即可)