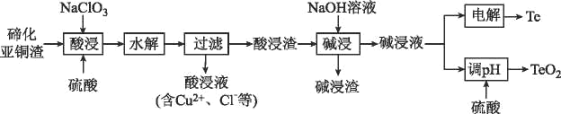
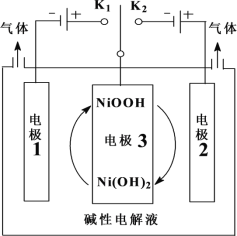
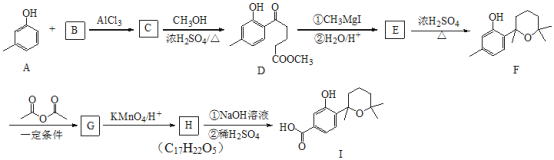
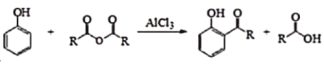
题目内容
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
反应 序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量 /kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:_______。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.0 | 1.5 | 1.1 | 0.8 | 0.8 |
n(CO)(乙容器)/mol | 2.0 | 1.45 | 1.0 | 1.0 | 1.0 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=________。
②该反应的ΔH________0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为________。
(4)如图是在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理模型。

①太阳能电池的负极是________。(填“a”或“b”)
②生成丙烯的电极反应式是_________。
【答案】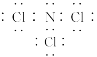 NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq)ΔH=-(4a-b)kJ/mol 0.0125 mol/(L·min) < 60% a 3CO2+18H++18e-=C3H6+6H2O
NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq)ΔH=-(4a-b)kJ/mol 0.0125 mol/(L·min) < 60% a 3CO2+18H++18e-=C3H6+6H2O
【解析】
(1)三氯化氮(NCl3)其原子均满足8e-结构,形成三个共用电子对,氯化铵和氯气反应生成三氯化氮和氯化氢;
(2)根据不同反应的量产生的热量写出热化学方程式,根据盖斯定律计算所求反应的热效应;
(3)①根据化学反应平均速率公式v(NO)=![]() 计算;
计算;
②对比甲容器和乙容器,相同时间内乙容器转化的NO的量更多,表明乙容器的化学反应速率更快,则乙容器温度更高,据此判断焓变情况;
③根据等效平衡以及甲容器的反应情况计算丙容器中NO的转化率;
(4)①负极通燃料,正极通氧气;
②太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,丙烯在阴极生成。
(1)三氯化氮原子均满足8e-结构,故电子式为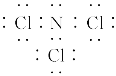 ;氯化铵与氯气生成三氯化氮,其方程式为:NH4Cl+3Cl2===NCl3+4HCl;
;氯化铵与氯气生成三氯化氮,其方程式为:NH4Cl+3Cl2===NCl3+4HCl;
故答案为: ;NH4Cl+3Cl2===NCl3+4HCl;
;NH4Cl+3Cl2===NCl3+4HCl;
(2)根据序号1的热化学方程式为:2CO2(g)+3NaOH(aq)===NaHCO3(aq)+Na2CO3(aq)+H2O(l) ΔH=-4a kJ/mol、序号2的热化学方程式为CO2(g)+2NaOH(aq)===Na2CO3(aq)+H2O(l) ΔH=-b kJ/mol,根据盖斯定律可得:NaOH(aq)+CO2(g)===NaHCO3(aq) ΔH=-(4a-b)kJ/mol;
故答案为:NaOH(aq)+CO2(g)===NaHCO3(aq) ΔH=-(4a-b)kJ/mol;
(3)①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=v(CO)=![]() =0.0125 mol/(L·min);
=0.0125 mol/(L·min);
故答案为:0.0125 mol/(L·min);
②根据甲乙容器可知,乙容器80 min达到平衡,甲容器在120 min达到平衡,故乙容器的温度高于甲容器,温度高CO的平衡浓度大,平衡逆向移动,所以该反应属于放热反应,ΔH<0;
故答案为:<;
③甲与丙的温度一样,故平衡常数不变。甲容器在300 ℃下的平衡常数为:
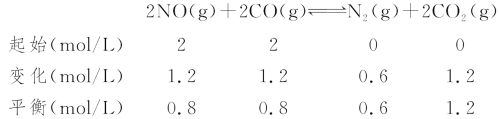
K=![]() =
=![]() =2.11
=2.11
丙容器在300 ℃下的平衡常数为:
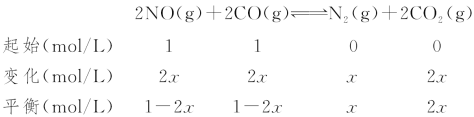
K=![]() =2.11,
=2.11,
解得x=0.3 mol/L,故丙容器达到平衡时,CO的转化率为60%,
故答案为:60%;
(4)①由图片可知,与a相连的电极:CO2→丙烯,发生还原反应,作阴极,故a为太阳能电池的负极;②生成丙烯的电极反应式为:3CO2+18H++18e-===C3H6+6H2O;
故答案为:a;3CO2+18H++18e-=C3H6+6H2O。

 优学名师名题系列答案
优学名师名题系列答案【题目】下表离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书 写正确的是( )
离子组 | 加入试剂 | 发生反应的离子方程式 | |
A |
| NaOH溶液 |
|
B |
| BaCl2溶液 |
|
C |
| 少量KOH溶液 |
|
D |
| 通入少量SO2 |
|
A.AB.BC.CD.D