��Ŀ����
����Ŀ���ܣ�Co����һ����Ҫ��ս�Խ������ܼ���Ͻ�㷺Ӧ���ڵ������е�����������պͺ�����������ڻ�������ͨ����+2��+3����ʽ���ڡ�
��1��д����̬Coԭ�ӵĺ�������Ų�ʽ___________________��
��2��Co2+��Co3+������CN-�γ���λ��Ϊ6�������ӡ�CN-��̼ԭ�ӵ��ӻ���ʽΪ_____��1mol HCN��������������ĿΪ_________��
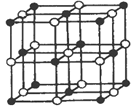
��3��Co��һ��������ľ�����ͼ��ʾ�����к������Co�������������Ļ�ѧʽΪ_______���ڸþ�������һ�������ӵȾ����������Co�������γɵĿռ乹��Ϊ___________��
��4����KCN������Co2+������Һ���к�ɫ��Co(CN)2�������������ڹ�����KCN��Һ��������ɫ��[Co(CN)6]4-������������һ���൱ǿ�Ļ�ԭ�����ڼ���ʱ����ˮ��Ӧ����[Co(CN)6]3-��д���÷�Ӧ�����ӷ���ʽ__________________��
���𰸡�1s22s22p63s23p63d74s2 sp 2NA CoO �������� 2[Co(CN)6]4- +2H2O=2[Co(CN)6]3-+H2��+2OH-
��������
��1��Co��27��Ԫ�أ����������Ϊ27�����������Ų�ʽΪ1s22s22p63s23p63d74s2��
��2��CN-��̼ԭ�ӵļ۲���Ӷ���=1+![]() ��2������1�Թµ��Ӷԣ�Cԭ�Ӳ�ȡsp�ӻ���ʽ��HCN�ĽṹʽΪH��C��N������Ϊ�����������к�1��������2����������1��HCN�����к���2����������1molHCN��������������ĿΪ 2NA��
��2������1�Թµ��Ӷԣ�Cԭ�Ӳ�ȡsp�ӻ���ʽ��HCN�ĽṹʽΪH��C��N������Ϊ�����������к�1��������2����������1��HCN�����к���2����������1molHCN��������������ĿΪ 2NA��
��3��������Coԭ����Ŀ=8��![]() +6��
+6��![]() =4��Oԭ����Ŀ=1+12��
=4��Oԭ����Ŀ=1+12��![]() =4���ʻ�ѧʽΪCoO�������ĵ�Oԭ���о�����֮�Ⱦ����������Co����λ�������ϣ�Co�������γɵĿռ乹��Ϊ�������塣
=4���ʻ�ѧʽΪCoO�������ĵ�Oԭ���о�����֮�Ⱦ����������Co����λ�������ϣ�Co�������γɵĿռ乹��Ϊ�������塣
��4��[Co(CN)6]4-����ǿ��ԭ�ԣ�����ˮ��Ӧ����[Co(CN)6]3-������������ԭ���غ������غ��֪����OH-���ɣ���Ӧ���ӷ���ʽΪ2[Co(CN)6]4-+2H2O��2[Co(CN)6]3-+H2��+2OH-��

����Ŀ��̽�����ᣨH2C2O4�����ʣ���������ʵ�顣����֪�������£�0.1 mol��L1 H2C2O4��pH=1.3��
ʵ�� | װ�� | �Լ�a | ���� |
�� |
| Ca(OH)2��Һ������̪�� | ��Һ��ɫ��������ɫ���� |
�� | ����NaHCO3��Һ | �������� | |
�� | ����KMnO4��Һ | ��ɫ��Һ��ɫ | |
�� | C2H5OH��Ũ���� | ���Ⱥ��������ζ���� |
������ʵ�����ò�����������Ӧ�ķ���ʽ����ȷ����
A. H2C2O4�����ԣ�Ca(OH)2+ H2C2O4![]() CaC2O4��+2H2O
CaC2O4��+2H2O
B. ���ԣ�H2C2O4> H2CO3��NaHCO3+ H2C2O4![]() NaHC2O4+CO2��+H2O
NaHC2O4+CO2��+H2O
C. H2C2O4���л�ԭ�ԣ�2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2��+ 8H2O
2Mn2++10CO2��+ 8H2O
D. H2C2O4�ɷ���������Ӧ��HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
����Ŀ����ʢ�в�ͬ�Լ����Թ�b�зֱ�μ�����0.1mol/L FeCl3 ��Һ�����ж�b����������ȷ����
ʵ�� | b������ | b������ | ���ۻ���� | |
| A | Mg(OH)2 ����Һ | �к���ɫ������� | ������Ӧ�� Fe3++3OH-= Fe(OH)3(����) |
B | Cu�� | ��Һ�������Թܵײ��й��� | ��Һ������ԭ���ǣ� 3Cu+2Fe3+ =2Fe+3Cu2+ | |
C | 5%H2O2��Һ | ���������� | ������Ϊ������˫��ˮ��ǿ����������Cl- ����Cl2 | |
D | ����NaHCO3��Һ | ���������ɣ����Թܵײ��й��� | ������Ӧ�� Fe3++3HCO3-= Fe(OH)3 +3CO2 |
A. A B. B C. C D. D