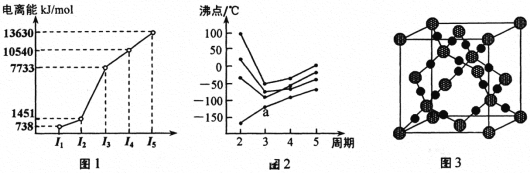
题目内容
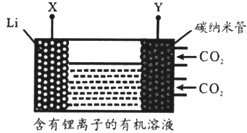
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
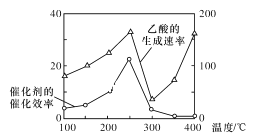
以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸,请写出该反应的化学方程式:____。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。在温度为____时,催化剂的活性最好,效率最高。请解释图中250~400℃时乙酸生成速率变化的原因:250~300℃时___;300~400℃时___。
【答案】CO2+CH4![]() CH3COOH 250℃ 催化剂效率下降是影响乙酸生成速率的主要原因 温度升高是影响乙酸生成速率的主要原因
CH3COOH 250℃ 催化剂效率下降是影响乙酸生成速率的主要原因 温度升高是影响乙酸生成速率的主要原因
【解析】
CO2和CH4在催化作用下生成CH3COOH,方程式为CO2+CH4![]() CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大。
CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大。
CO2和CH4在催化作用下生成CH3COOH,方程式为CO2+CH4![]() CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大,因此在250℃-300℃之间,催化剂是影响反应速率的主要因素,催化效率的降低,导致反应速率也降低;在300℃-400℃时,催化效率降低且变化程度较小,反应速率增加明显,因此过程中温度是影响反应速率的主要因素,温度越高,反应速率越快。
CH3COOH,由图象可知,当温度低于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而增大,250℃时均达到最大值,当温度高于250℃时,催化剂的催化效率和乙酸的生成速率为温度的升高而降低,温度高于300℃时,催化剂的催化效率继续降低,乙酸的生成速率却随温度的升高而增大,因此在250℃-300℃之间,催化剂是影响反应速率的主要因素,催化效率的降低,导致反应速率也降低;在300℃-400℃时,催化效率降低且变化程度较小,反应速率增加明显,因此过程中温度是影响反应速率的主要因素,温度越高,反应速率越快。
条件 | 原则 |
从化学反应速率分析 | 既不能过快,又不能太慢 |
从化学平衡移动分析 | 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性 |
从原料的利用率分析 | 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本 |
从实际生产能力分析 | 如设备承受高温、高压能力等 |
从催化剂的使用活性分析 | 注意催化剂的活性对温度的限制 |

【题目】二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了CH3OCH3的产率,原因是___。