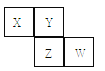题目内容
【题目】向盛有不同试剂的试管b中分别滴加适量0.1mol/L FeCl3 溶液,下列对b中现象及解释正确的是
实验 | b中物质 | b中现象 | 结论或解释 | |
| A | Mg(OH)2 悬浊液 | 有红棕色胶体产生 | 发生反应: Fe3++3OH-= Fe(OH)3(胶体) |
B | Cu粉 | 溶液变蓝,试管底部有固体 | 溶液变蓝的原因是: 3Cu+2Fe3+ =2Fe+3Cu2+ | |
C | 5%H2O2溶液 | 有气泡生成 | 该气体为氯气,双氧水有强氧化性氧化Cl- 产生Cl2 | |
D | 饱和NaHCO3溶液 | 有气泡生成,且试管底部有固体 | 发生反应: Fe3++3HCO3-= Fe(OH)3 +3CO2 |
A. A B. B C. C D. D
【答案】D
【解析】Mg(OH)2悬浊液滴入氯化铁溶液,氢氧化镁沉淀转化为氢氧化铁胶体,发生反应2Fe3++3Mg(OH)2= 2Fe(OH)3(胶体)+3Mg2+,故A错误;氯化铁与铜反应Cu+2Fe3+ =2Fe2++Cu2+,故B错误;5%H2O2溶液滴入氯化铁溶液,生成氧气,是因为氯化铁做过氧化氢分解的催化剂,故C错误;饱和NaHCO3溶液与氯化铁发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,故D正确。

 阅读快车系列答案
阅读快车系列答案【题目】近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(l)汽车发动机工作时会引起反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
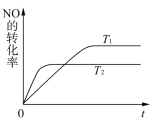
① 反应2NO(g)![]() N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到平衡的是_____(填序号);
N2(g)+O2(g)已达到平衡的是_____(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c. 2NO、N2、O2的浓度保持不变
d.单位时间内分解4molNO,同时生成2molN2
③ 在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mol)如下表所示。相同条件下达到平衡后,N2的体积分数最大的是_______(填容器代号);
容器代号 | NO | N2 | O2 |
A | 2 | 0 | 0 |
B | 0 | l | l |
C | 0.4 | 0.6 | 0.8 |
D | l | 0.5 | 0.4 |
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:___________;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为___________________。
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
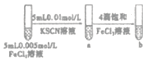
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
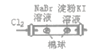
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D