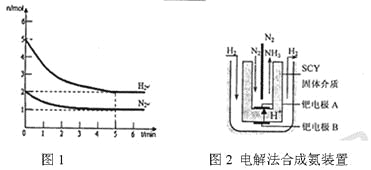
��Ŀ����
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߡ�����������ʾ���ʱ仯�Ļ�ѧ�����У�������ǣ� ��
A.������ʴʱ���ܷ�����������Ӧ��2H2O + O2+ 4e-= 4OH-
B.��ʾH2ȼ���ȵ��Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��g������H=-483.6kJ/mol
C.����ˮ������ӷ���ʽ��CO32-+H2O![]() HCO3-+ OH-
HCO3-+ OH-
D.Ca(HCO3)2��Һ�м����������ʯ��ˮ��Ca2++HCO3��+OH��=CaCO3��+H2O
���𰸡�B
��������
A��2H2O + O2+ 4e-= 4OH-Ϊ������ʴ��������Ӧ����ȷ��
B��ȼ������ָ1 mol�Ŀ�ȼ����ȫȼ�������ȶ���������ʱ���ų�������������Ŀ�з���ʽ������ϵ��Ϊ2������ˮΪ��̬����Һ̬��������
C����Ԫ��������ӷֲ�ˮ�⣬��ȷ��
D����������ʯ��ˮ�����Բ�����������ӣ�ȫ��ת��Ϊ��������ȷ��
�ʴ�ΪB��

����Ŀ����һ���¶��£�������X������Y ��0.16 mol����10 L �����ܱ������У�������Ӧ
X(g) + Y(g) ![]() 2Z(g) H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±�������˵����ȷ����
2Z(g) H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±�������˵����ȷ����
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A����Ӧǰ2min��ƽ������v(Z)=2.0��10�C5 mol/(L��min)
B�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)��v(��)
C�����¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D�������������䣬�ٳ���0.2 mol Z��ƽ��ʱX�������������