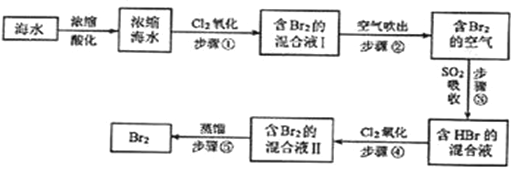
��Ŀ����
����Ŀ����Ҫ��ش��������⣺
(1)HClO�ĵ��뷽��ʽΪ__________________________��
(2)�����ӷ���ʽ�������ο����ھ�ˮ��ԭ��__________________________��
(3)��NaOH ��Һ������ϡ��������Һ�����ԣ���������Һ��c(Na+)_______c(CH3COO-)(�����������������ͬ)��
(4)��ͬpH��NH4Cl��Һ��NH4HSO4��Һ��NH4+Ũ�ȵĴ�С��ϵ:ǰ��_______���ߡ�
(5)�ö��Ե缫���500mLijŨ�ȵ�CuSO4��Һһ��ʱ���CuSO4�պ÷�Ӧ�꣬��Ҫ����16gCuO���ܸ�ԭ����ԭCuSO4��Һ��������Ũ��Ϊ___________��
���𰸡�HClO ![]() H+ + ClO- Fe3++3H2O
H+ + ClO- Fe3++3H2O ![]() Fe(OH)3(����) + 3H+ = > 0.4mol��L��1
Fe(OH)3(����) + 3H+ = > 0.4mol��L��1
��������
(1)HClO�����ᣬ���ֵ��룬�����ÿ�����š�
(2)���ο����ھ�ˮ��ԭ������Ҫ��������ˮ�����������������壬��������������ʹ��ܣ���д���ӷ���ʽҪд������š�
(3)��NaOH��Һ������ϡ��������Һ�����ԣ�������Һ����غ�ͳ�����ԭ�õ���Һ��������Ũ�Ⱥʹ����������ȡ�
(4)��ͬpH��NH4Cl��Һ��NH4HSO4��Һ��NH4+Ũ�ȵĴ�С��ϵ��ǰ����ˮ�������ԣ�ˮ��̶�С�����ʣ��笠�����Ũ�ȴ����ǵ��������ԣ�ˮ��̶Ⱥ�С��NH4HSO4�������笠�����С��
(5)�ȼ�������ͭ���ʵ������ٸ����غ�õ�����ͭ�����ʵ������ټ���Ũ�ȡ�
(1)HClO�����ᣬ���ֵ��룬����뷽��ʽΪHClO ![]() H+ + ClO�����ʴ�Ϊ��HClO
H+ + ClO�����ʴ�Ϊ��HClO ![]() H+ + ClO����
H+ + ClO����
(2)�����ӷ���ʽ�������ο����ھ�ˮ��ԭ������Ҫ��������ˮ�����������������壬��������������ʹ��ܣ�Fe3++3H2O ![]() Fe(OH)3(����) + 3H+���ʴ�Ϊ��Fe3++3H2O
Fe(OH)3(����) + 3H+���ʴ�Ϊ��Fe3++3H2O ![]() Fe(OH)3(����) + 3H+��
Fe(OH)3(����) + 3H+��
(3)��NaOH ��Һ������ϡ��������Һ�����ԣ�������Һ����غ�ͳ����ԣ��ó���Һ��c(Na+)��c(CH3COO��)���ʴ�Ϊ������
(4)��ͬpH��NH4Cl��Һ��NH4HSO4��Һ��NH4+Ũ�ȵĴ�С��ϵ��ǰ����ˮ�������ԣ������ǵ��������ԣ�ˮ��̶Ⱥ�С������Ȼ����笠�����Ũ�ȴ�NH4HSO4�������笠�����С�����ǰ��>���ߣ��ʴ�Ϊ��>��
(5)�ö��Ե缫���500mLijŨ�ȵ�CuSO4��Һһ��ʱ���CuSO4�պ÷�Ӧ�꣬��Ҫ����16gCuO���ܸ�ԭ������ͭ�����ʵ���Ϊ![]() ������ͭ�غ�õ�����ͭ�����ʵ���Ϊ0.2mol����ԭCuSO4��Һ��������Ũ��Ϊ
������ͭ�غ�õ�����ͭ�����ʵ���Ϊ0.2mol����ԭCuSO4��Һ��������Ũ��Ϊ![]() ���ʴ�Ϊ��0.4mol��L��1��
���ʴ�Ϊ��0.4mol��L��1��