题目内容
【题目】(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的△H=___________。
2NH3(g)的△H=___________。
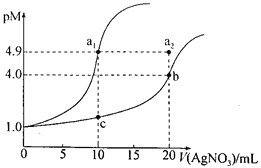
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3)______________;
②达到平衡时NH3的体积分数为______________________。
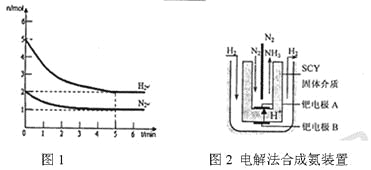
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是__________________。
【答案】-92.4kJ.mol-1 0.04mol·L-1·min-1 40% N2+6e-+6H+=2NH3
【解析】
(1)根据热化学方程式和盖斯定律计算得到所需热化学方程式的反应焓变;
(2)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,分析反应情况如图1所示得到各量;
①根据图象分析氮气和氢气的量,计算氨气的量,结合化学反应速率概念计算得到;
②反应前后气体减少是生成氨气的物质的量;
(3)根据氮气和氢气合成氨的反应过程中,原电池中氮气在正极上得到电子发生还原反应,氢气在负极上失电子发生氧化反应。
已知:①N2(g)+O2(g)=2NO(g)△H=+180.5 kJ·mol-1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905 kJ·mol-1
③2H2(g)十O2(g)=2HO(g)△H=--483.6 kJ·mol-1
根据盖斯定律:①×2-[③×3-②]可得:2N2(g)+6H2(g)![]() 4NH3(g)的△H=-184.8 kJ·mol-1;所以N2(g)+3H2(g)
4NH3(g)的△H=-184.8 kJ·mol-1;所以N2(g)+3H2(g)![]() 2NH3(g)的△H=-92.4 kJ·mol-1;
2NH3(g)的△H=-92.4 kJ·mol-1;
(2)根据图象分析,写出化学平衡三段式数据,进行计算
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol) 2 5 0
变化量(mol) 1 3 2
平衡量(mol) 1 2 2
①求5min内的平均反应速率v(NH3)=![]() =0.04mol·L-1·min-1;
=0.04mol·L-1·min-1;
②平衡时氨气的体积分数等于其物质的量的百分含量=![]() ×100%=40%;
×100%=40%;
(3)氮气和氢气合成氨的反应过程中,原电池中氮气在正极上得到电子发生还原反应,氢气在负极上失电子发生氧化反应,钯电极A上发生的是氮气得到电子生成氨气的反应,高质子导电性的SCY陶瓷(能传递H+)为介质,电极反应为:N2+6e-+6H+=2NH3。

 阅读快车系列答案
阅读快车系列答案【题目】如图图象中,纵坐标为沉淀物的物质的量,横坐标为向溶液中加入反应物的物质的量,则相应的图像序号与(1)—(4)对应的是
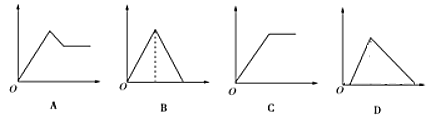
溶液 | 加入物质 | 对应的图像 |
(1)饱和石灰水 | 通过量CO2气体 | ____ |
(2)氯化铝溶液 | 加入过量氨水 | ____ |
(3)MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 | ____ |
(4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 | ____ |