题目内容
【题目】以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7是一种强氧化剂)的主要工艺流程如下:
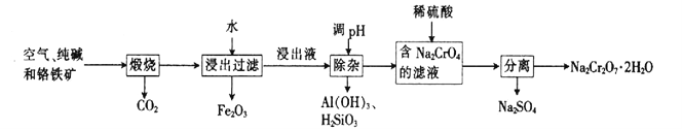
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
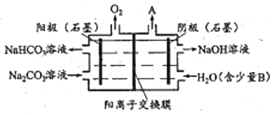
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,
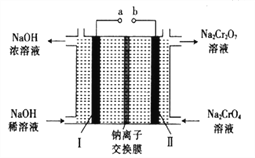
①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4转化为1malNa2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3位有效数字)。
【答案】 +3 4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2 CrO42-会被盐酸中的Cl-还原,并产生有毒气体Cl2(或其他合理答案) 2 CrO42-+2H+
2Fe2O3+8Na2CrO4+8CO2 CrO42-会被盐酸中的Cl-还原,并产生有毒气体Cl2(或其他合理答案) 2 CrO42-+2H+![]() Cr2O72-+H2O中,增大氢离子浓度,平衡向右移动 CO2 2H2O+2e-=H2↑+2OH- 2mol 滴加最后一滴硫代硫酸钠溶液后,溶液蓝色刚好褪去,且振荡后半分钟内不恢复蓝色 95.4%
Cr2O72-+H2O中,增大氢离子浓度,平衡向右移动 CO2 2H2O+2e-=H2↑+2OH- 2mol 滴加最后一滴硫代硫酸钠溶液后,溶液蓝色刚好褪去,且振荡后半分钟内不恢复蓝色 95.4%
【解析】(1)根据化合物的组成可知:Fe为+2价,O为-2价,根据化合价法则,Cr的化合价是+3价;正确答案:+3。
(2)根据流程可知:煅烧生成Na2CrO4可以生成CO2,+2价铁氧化为+3价铁,化学方程式为4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2;正确答案:4Fe(CrO2)2+7O2+8Na2CO3
2Fe2O3+8Na2CrO4+8CO2;正确答案:4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2。
2Fe2O3+8Na2CrO4+8CO2。
(3)酸化滤液Na2CrO4时,不选用盐酸的原因是CrO42-会被盐酸中的Cl-还原,并产生有毒气体Cl2 ;针对于2CrO42-+2H+==Cr2O72-+H2O反应来说中,增大氢离子浓度,平衡向右移动; 正确答案:CrO42-会被盐酸中的Cl-还原,并产生有毒气体Cl2 ;2 CrO42-+2H+==Cr2O72-+H2O中,增大氢离子浓度,平衡向右移动。
(4)样品煅烧后,产生二氧化碳,通入含有偏铝酸钠和硅酸钠的溶液中,生成氢氧化铝和
硅酸沉淀,溶液为碳酸氢钠,碳酸氢钠加热又可生成二氧化碳;该工艺中CO2可以再利用;正确答案:CO2 。
(5)通过电解Na2CrO4溶液装置图可知,用石墨电极电解时,左侧装置内氢氧化钠溶液的浓度增大,溶液中的氢氧根离子浓度增大,说明该极为电解池的阴极,发生了还原反应,极反应为:2H2O+2e-===H2↑+2OH-;正确答案:2H2O+2e-===H2↑+2OH-。
②根据反应2CrO42-+2H+==Cr2O72-+H2O可知,当Na2CrO4转化为1mol Na2Cr2O7时,需要消耗2molH+,转移电子的物质的量为2mol;正确答案:2mol。

【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
KⅠ | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1,计算可得此段时间的反应速率(用H2表示)为________mol·L-1·min-1。
(2)由表中数据判断ΔH1______(填“>”“<”或“=”)0;反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3=_________(用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3=_________(用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是______(填序号)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=__________________;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡_______(填“正向”“逆向”或“不”)移动,平衡常数KⅡ__________(填“变大”“变小”或“不变”)。
(5)比较这两种合成甲醇的方法,原子利用率较高的是______(填“Ⅰ”或“Ⅱ”)。