题目内容
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:
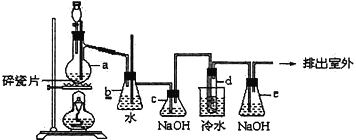
(1)图中碎瓷片的作用是_________________________,若在反应过程中发现未加碎瓷片,应该_____________________________。
(2)烧瓶a中温度计的作用是___________________,该反应是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。请你写出该副反应的反应方程式:_______________________________。
(3)写出制备1, 2-二溴乙烷的化学方程式:_______________________________。
(4)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________。
(5)容器c中NaOH溶液的作用是:_______________________________。
(6)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_________________________。
(7)e装置内NaOH溶液的作用是_________________________________________________。
【答案】 防止暴沸 待装置冷却到室温补加沸石(碎瓷片) 监测反应温度 2C2H6OH![]() C2H6—O—C2H6+ H2O CH2=CH2+Br2→CH2BrCH2Br b中水面会下降,玻璃管中的水面会上升,甚至溢出 除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫; 乙烯发生(或通过液溴)速度过快②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃ 吸收挥发出来的溴,防止污染环境
C2H6—O—C2H6+ H2O CH2=CH2+Br2→CH2BrCH2Br b中水面会下降,玻璃管中的水面会上升,甚至溢出 除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫; 乙烯发生(或通过液溴)速度过快②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃ 吸收挥发出来的溴,防止污染环境
【解析】分析:该实验题的目的是制备1,2-二溴乙烷,a装置用乙醇和浓硫酸在170℃下制备乙烯,将乙烯通入溴水加成制得1,2-二溴乙烷,在乙醇和浓硫酸制备乙烯时,还可能有副反应的发生,从a装置中出来的气体除了乙烯还可能有乙醇、二氧化碳、二氧化硫酸性气体,故b装置用来吸收乙醇,c装置用来除去乙烯中带出的酸性气体,d中可能有溴蒸汽逸出,e装置内NaOH溶液的作用是除去溴蒸气,防止污染空气。
详解:(1)碎瓷片的作用是防止暴沸,若在反应过程中发现未加碎瓷片,应该待装置冷却到室温补加沸石(碎瓷片) 。
(2)烧瓶a中发生:乙醇消去可得乙烯:![]() ,该反应的温度要求是170℃,故温度计的作用是检测反应温度,并且该反应要求温度迅速高到170℃,否则容易产生副反应,在140℃时,乙醇分子间脱水生成乙醚,该副反应的反应方程式为:
,该反应的温度要求是170℃,故温度计的作用是检测反应温度,并且该反应要求温度迅速高到170℃,否则容易产生副反应,在140℃时,乙醇分子间脱水生成乙醚,该副反应的反应方程式为:![]() ;
;
乙烯与溴的加成可得1,2-二溴乙烷:CH2=CH2+Br2 → CH2Br-CH2Br
(3)在装置d中乙烯和溴水制备1, 2-二溴乙烷,化学方程式为:CH2=CH2+Br2→CH2BrCH2Br;
(4)发生堵塞时瓶b中气体压强增大,可看到的现象是b中水面会下降,玻璃管中的水面会上升,甚至溢出;
(5)c装置内NaOH溶液可吸收乙烯中可能混有的SO2和CO2气体;
(6)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,消耗的反应物超过理论值,可能是反应速率过快,乙烯没有完全被溴水吸收;也可能是乙烯和浓硫酸的混合液没有迅速达到170℃,反应过程中有副产物生成;
(7)d中可能有溴蒸汽逸出,e装置内NaOH溶液的作用是除去溴蒸气,防止污染空气。


