题目内容
【题目】(1)请从Cl2、H2、CO2、NO、NH3气体中选择一种气体,该气体在实验室可以用如图装置制取、净化、收集(可以含水蒸气),制取该气体的化学反应方程式为_____________;

(2)已知:
可用下述装置制取1,2 - 二溴乙烷(无色液体,密度2.18 g·cm-3,熔、沸点为9.79℃、131.4℃,不溶于水);试管d中装有液溴(表面覆盖少量水)。

①e装置的作用是____________;当观察到_________现象时,试管d中反应基本结束;
②若用冰水代替烧杯中的冷水,可能引起的不安全后果是______________;
③实验结束后,要精制试管d中的粗产品,操作先后顺序是______(填标号)
A.蒸镏 B.水洗 C.用干燥剂干燥 D.10%NaOH溶液洗 E.水洗
④实验消耗40%乙烯利(摩尔质量为M)溶液50g,制得产品m g,则乙烯利合成1,2 - 二溴乙烷的产率为_____________(用含M,m的代数式表示);
⑤设计实验证明,反应后烧瓶中的混合溶液含有Cl-、PO43-,简述实验方案。已知:氯化银、磷酸银(黄色)、磷酸钡(白色)的KSP分别为1.77×10-10、8.88×10-17 和3.4×10-23。
答:_____________________________________________________________________。
【答案】 CaCO3+2HCl=CaCl2+CO2↑+H2O 吸收溴蒸汽 试管内溶液褪为无色 d中长导管堵塞 BDECA或EDBCA ![]() 取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-
取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-
【解析】(1)按此装置,收集的气体的密度必须大于空气,H2、NH3的密度小于空气,不能用此装置收集;NO与空气中的氧气反应,不能用此装置收集;Cl2的制备需要加热装置;所以此装置只能用来制备和收集CO2,实验室制取CO2用稀盐酸和碳酸钙反应,制取该气体的化学反应方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O 答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)①d中的液溴易挥发,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收Br2蒸气,防止大气污染;d中乙烯与溴发生加成反应使液溴褪色,生成的1,2 - 二溴乙烷为无色,当观察到试管内溶液褪为无色时说明d中反应基本结束。②冰水的温度低于冷水,温度过低会使1,2 - 二溴乙烷凝结为固体,导致d中长导管堵塞,发生危险。③实验结束后,要精制试管d中的粗产品,将粗产品先用水洗涤,再用10%NaOH溶液和水洗涤,分离后加入无水氯化钙干燥,待溶液澄清后进行蒸馏,可以得到纯净的1,2 - 二溴乙烷。④乙烯利合成1,2 - 二溴乙烷的产率=![]() ⑤由已知条件可知氯化银、磷酸银(黄色)、磷酸钡(白色)都是沉淀,且磷酸钡比氯化银更难溶,所以应该先检验PO43-再检验Cl-,可设计实验如下:取适量混合溶液于试管中,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置一段时间,取上层清液少量于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-。答案为:① 吸收溴蒸汽 、试管内溶液褪为无色 ②d中长导管堵塞③ BDECA或EDBCA ④
⑤由已知条件可知氯化银、磷酸银(黄色)、磷酸钡(白色)都是沉淀,且磷酸钡比氯化银更难溶,所以应该先检验PO43-再检验Cl-,可设计实验如下:取适量混合溶液于试管中,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置一段时间,取上层清液少量于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-。答案为:① 吸收溴蒸汽 、试管内溶液褪为无色 ②d中长导管堵塞③ BDECA或EDBCA ④ ![]() ⑤取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-
⑤取适量混合溶液,加入过量的Ba(NO3)2溶液,产生白色沉淀,证明溶液中存在PO43-;静置,取上层清液于试管中,加入过量稀硝酸和AgNO3溶液,产生白色沉淀,证明溶液中存在Cl-

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
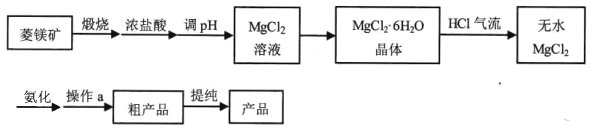
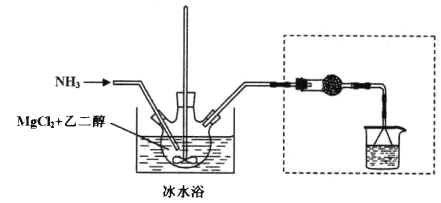
其中氨化过程装置示意图如下:
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
【题目】I 有一种有机物X,其结构简式为:HO—CH2CH=CH—COOH,试回答下列问题:
(1)X中的含氧官能团名称是_______________、_______________。
(2)向X中加入金属钠,将发生反应的化学方程式是_______________。
(3)如果在X中加入NaOH溶液,将发生反应的化学方程式是___________。
(4)下列关于X的说法中正确的是________________。
①X既能与酸发生酯化反应,又能与醇发生酯化反应
②X能够使溴水褪色,但不能使KMnO4酸性溶液褪色
③X能够发生缩聚反应,但不能发生加聚反应
II.分子式为C3H6O2的有机物有多种同分异构体,现有其中的四种X、Y、Z、W,它们的分子中均含甲基,将它们分别进行下列实验以鉴别,其实验记录如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
W | 水解反应 | 无现象 | 无现象 | 无现象 |
回答下列问题:
(1)写出X的结构简式________, W的系统命名是________.
(2)①Y在一定条件下发生分子内的脱水反应的化学方程式________________
②Z与NaOH溶液反应的化学方程式_______________________________



