题目内容
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
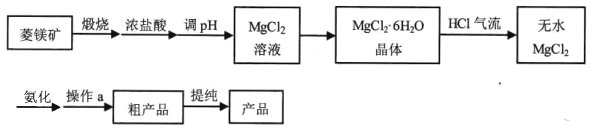
其中氨化过程装置示意图如下:
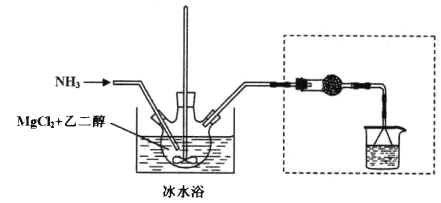
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
【答案】 MgO MgC12+H2O![]() Mg(OH)Cl+HCl↑
Mg(OH)Cl+HCl↑![]() 吸收氨气,防止水蒸气进入三颈烧瓶中 过滤 C 避免 NH3与银离子络合,干扰检测 50.00% 氨化过程不完全或晶体称量时己有部分氨气逸出
吸收氨气,防止水蒸气进入三颈烧瓶中 过滤 C 避免 NH3与银离子络合,干扰检测 50.00% 氨化过程不完全或晶体称量时己有部分氨气逸出
【解析】(1)为了不引入新的杂质,调pH合适的物质为MgO,同时过量的MgO过虑即可除去;
(2)加热能促进Mg2+水解生成Mg(OH)Cl等,反应的方程式为MgC12+H2O![]() Mg(OH)Cl+HCl↑,所以在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2;
Mg(OH)Cl+HCl↑,所以在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2;
(3)倒置漏斗用于吸收剩余的氨气,干燥管用于防止水蒸气进入三颈瓶中;由于六氨氯化镁不溶于乙二醇,所以可用过滤的方法得到粗产品;
(4)根据甲醇沸点65℃和乙二醇的沸点197℃,产品在二者中都是难溶的,所以用氨气饱和的甲醇溶液洗涤粗产品,因甲醇和氨气都易挥发,更有利于提纯产品,因此正确答案为C;
(5)①检验Cl-需要用AgNO3,而Ag+能与NH3络合生成[Ag(NH3)2]+,所以加入硫酸除去NH3;②由实验数据可得n(AgNO3)=10.00×10-3L×0.2000mol·L-1=0.002000mol,所以Cl-的百分含量=![]() ×100%=50.00%;③根据MgCl2·6NH3的组成可得,其中Cl-的百分含量=
×100%=50.00%;③根据MgCl2·6NH3的组成可得,其中Cl-的百分含量=![]() ×100%=36.04%,但实验结果偏高,可能是MgCl2没有完全氨化,也可能是产品在称量时己有部分氨气逸出。
×100%=36.04%,但实验结果偏高,可能是MgCl2没有完全氨化,也可能是产品在称量时己有部分氨气逸出。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】已知下表为 25℃时某些弱酸的电离平衡常数,依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO— + CO2 + H2O═2HClO + CO32—
B. 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH) + c(HClO) ═ c(OH—) – c(H+)
C. 25℃时,0.1mol/LCH3COONa溶液中通入CO2至溶液的PH=7时,溶液中:c(Na+) ═ c(CO32—) + c(HCO3—) + c(H2CO3)
D. 向0.1mol/LCH3COONa溶液中加入少量水,溶液中 c(CH3COO—)/c(CH3COOH).c(OH—)增大



