题目内容
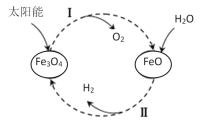
【题目】氨气是重要的化工原料。
(1)检验氨气极易溶于水的简单操作是:收集一试管氨气,______________。
(2)往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为_________;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入________,请说明这样操作为什么可以析出较多NH4Cl的原因:_________________。某NaHCO3晶体中含有NaCl杂质,某同学在测定其中NaHCO3的含量时,称取5.000g试样,定容成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol/L盐酸溶液的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
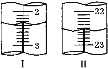
第二次 | 20.00 | 如图Ⅰ | 如图Ⅱ |
(3)定容过程中需要用到的仪器有烧杯、玻璃棒、___________和____________。
(4)当滴定至__________________________,即为滴定终点;第二次滴定,从图I图II显示消耗的盐酸溶液体积为_________mL。
(5)该实验测定样品中NaHCO3的质量分数为__________(保留2位小数)。
(6)若该同学测定结果偏大,请写出一个造成该误差的原因_____________。
【答案】倒插入水中,水迅速充满试管 NaHCO3 NaCl 足量的NH3、冷却并加入NaCl,能够增大NH4+和Cl-的浓度,使平衡NH4Cl(s)NH4+(aq)+Cl-(aq)逆向移动 100mL容量瓶 胶头滴管 溶液由橙色变成黄色,且半分钟内部变色 20.20 84.42% 滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定(或滴定前有气泡,滴定后气泡消失或锥形瓶用待测液润洗了等)
【解析】
(1)根据氨气极易溶于水分析解答;
(2)根据侯氏制碱法的反应原理分析判断;结合NH4Cl饱和溶液中存在NH4Cl(s)NH4+(aq)+Cl-(aq)的平衡分析解答;
(3)根据定容的操作分析解答;
(4) 碳酸氢钠溶液显碱性,用甲基橙做指示剂时,开始时溶液显橙色,解甲基橙的变色范围分析判断;根据滴定管的结构结合图I图II读出初读数和终读数,再计算消耗的盐酸溶液体积;
(5)计算两次消耗盐酸的平均值,计算消耗盐酸的物质的量,依据方程式:HCl+NaHCO3=NaCl+H2O+CO2↑,然后计算碳酸氢钠的物质的量和质量,计算其质量分数;
(6)根据c(待测)=![]() ,测定结果偏大,造成该误差的原因为V(标准)偏大,结合造成V(标准)偏大的可能因素解答。
,测定结果偏大,造成该误差的原因为V(标准)偏大,结合造成V(标准)偏大的可能因素解答。
(1)检验氨气易溶于水的简单操作是:收集一试管氨气,将试管倒插入水中,水迅速充满试管,故答案为:倒插入水中,水迅速充满试管;
(2)根据侯氏制碱法的反应原理,往饱和食盐水中依次通入足量的NH3和足量的CO2,可生成碳酸氢钠沉淀;NH4Cl饱和溶液中存在NH4Cl(s)NH4+(aq)+Cl-(aq),为尽可能析出较多NH4Cl晶体,可以向溶液中再通入足量的NH3、冷却并加入NaCl,可使平衡逆向移动,故答案为:NaHCO3;NH3;NaCl;足量的NH3、冷却并加入NaCl,能够增大NH4+和Cl-的浓度,使平衡NH4Cl(s)NH4+(aq)+Cl-(aq)逆向移动;
(3)定容过程中需要用到的仪器有烧杯、玻璃棒、100mL容量瓶和胶头滴管,故答案为:100mL容量瓶;胶头滴管;
(4) 用甲基橙做指示剂,用标准盐酸溶液滴定NaHCO3,碳酸氢钠溶液显碱性,开始时溶液显橙色,当滴入最后一滴盐酸,溶液由橙色变成黄色,且半分钟内部变色,即为滴定终点;根据图I图II,初读数为2.40 mL,终读数为22.60mL,则消耗的盐酸溶液体积20.20 mL,故答案为:溶液由橙色变成黄色,且半分钟内部变色;20.20 ;
(5)第一次消耗盐酸的体积是21.00mL-1.00mL=20.00mL,所以两次消耗盐酸的平均值是![]() =20.10mL,所以消耗盐酸的物质的量是0.0201L×0.5000mol/L;根据方程式HCl+NaHCO3=NaCl+H2O+CO2↑可知,碳酸氢钠的物质的量是0.0201L×0.5000mol/L,质量是0.0201L×0.5000mol/L×84g/mol,所以碳酸氢钠的纯度是
=20.10mL,所以消耗盐酸的物质的量是0.0201L×0.5000mol/L;根据方程式HCl+NaHCO3=NaCl+H2O+CO2↑可知,碳酸氢钠的物质的量是0.0201L×0.5000mol/L,质量是0.0201L×0.5000mol/L×84g/mol,所以碳酸氢钠的纯度是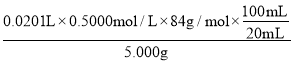 ×100%=84.42%,故答案为:84.42%;
×100%=84.42%,故答案为:84.42%;
(6)若该同学测定结果偏大,造成该误差的原因可能是滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定(或滴定前有气泡,滴定后气泡消失或锥形瓶用待测液润洗了等),故答案为:滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定(或滴定前有气泡,滴定后气泡消失或锥形瓶用待测液润洗了等)。

 阅读快车系列答案
阅读快车系列答案【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D