题目内容
【题目】沼气的主要成分是CH4,还含有CO2、H2S等。Jo De Vrieze等设计了利用膜电解法脱除沼气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图所示。
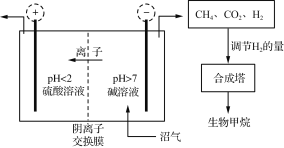
(1) 需控制电解槽中阴极室pH>7,其目的是________________。
(2) 阳极室逸出CO2和________(填化学式);H2S在阳极上转化为SO42-而除去,其电极反应式为___________________。
(3) 在合成塔中主要发生的反应为:
反应Ⅰ: CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH1
反应Ⅱ: CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
调节![]() =4,充入合成塔,当气体总压强为0.1 MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
=4,充入合成塔,当气体总压强为0.1 MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
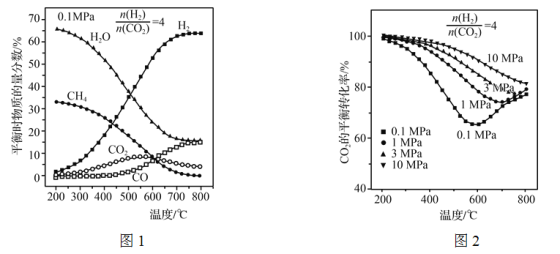
①反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=________(用ΔH1、ΔH2表示)。
②图1中,200~550 ℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③图2中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________________;在压强为10 MPa时,当温度在200~800 ℃范围内,随温度升高,CO2的平衡转化率始终减小,其原因是________________________。
【答案】将H2S转化为HS-(S2-),部分CO2转化为HCO3- (CO32-) O2 H2S+4H2O-8e-===10H++SO42- 2ΔH2—ΔH1 ΔH1<0,ΔH2>0,温度升高时,反应Ⅰ向左移动增加的CO2的量大于反应Ⅱ向右移动减少的CO2的量 增大压强,反应Ⅱ不移动,反应Ⅰ向正反应方向移动 反应Ⅰ中CO2减小的平衡转化率始终大于反应Ⅱ中CO2增大的平衡转化率(或反应Ⅰ、Ⅱ中CO2平衡时的净转化率呈减小趋势)
【解析】
(1) 沼气中的CO2和H2S,需在阴极室中处理达到合成高纯度生物甲烷要求,需控制电解槽中阴极室pH>7,其目的是将H2S转化为HS-(S2-),部分CO2转化为HCO3- (CO32-)。
(2) 阳极:2H2O -4e-=4H++O2↑,阳极室逸出CO2和O2;H2S在阳极上转化为SO42-而除去,其电极反应式为H2S+4H2O-8e-=10H++SO42-。
(3) ①反应Ⅰ: CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH1,反应Ⅱ: CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2,由盖斯定律,反应Ⅱ×2-反应Ⅰ,反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=2ΔH2—ΔH1。
②图1中,200~550 ℃时,CO2的物质的量分数随温度升高而增大的原因是:ΔH1<0,ΔH2>0,温度升高时,反应Ⅰ向左移动增加的CO2的量大于反应Ⅱ向右移动减少的CO2的量。
③图2中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是:增大压强,反应Ⅱ不移动,反应Ⅰ向正反应方向移动;
在压强为10 MPa时,当温度在200~800 ℃范围内,随温度升高,CO2的平衡转化率始终减小,其原因是:反应Ⅰ中CO2减小的平衡转化率始终大于反应Ⅱ中CO2增大的平衡转化率(或反应Ⅰ、Ⅱ中CO2平衡时的净转化率呈减小趋势)。

 期末集结号系列答案
期末集结号系列答案【题目】氨气是重要的化工原料。
(1)检验氨气极易溶于水的简单操作是:收集一试管氨气,______________。
(2)往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为_________;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入________,请说明这样操作为什么可以析出较多NH4Cl的原因:_________________。某NaHCO3晶体中含有NaCl杂质,某同学在测定其中NaHCO3的含量时,称取5.000g试样,定容成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol/L盐酸溶液的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如图Ⅰ | 如图Ⅱ |
(3)定容过程中需要用到的仪器有烧杯、玻璃棒、___________和____________。
(4)当滴定至__________________________,即为滴定终点;第二次滴定,从图I图II显示消耗的盐酸溶液体积为_________mL。
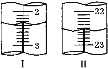
(5)该实验测定样品中NaHCO3的质量分数为__________(保留2位小数)。
(6)若该同学测定结果偏大,请写出一个造成该误差的原因_____________。
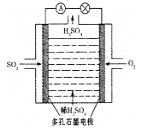
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
化学键 | H—H | O=O | O—H |
键能/KJmol-1 | 436 | 498 | 463.5 |
则△H3=___,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据
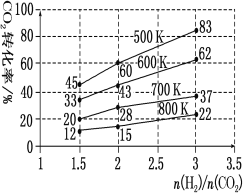
①降低温度,平衡向____方向移动。
②在700K、起始投料比![]() =1.5时,H2的转化率为___。
=1.5时,H2的转化率为___。
③在500K、起始投料比![]() =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___极,写出该电池负极的电极反应式___。