题目内容
5.已知25℃时有关弱酸的电离平衡常数如下表:| 弱酸化学式 | HCN | H2CO3 |
| 电离平衡常数(25℃) | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | Na2CO3溶液中滴入等体积、等浓度的盐酸后,溶液中一定存在:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-) | |
| B. | Na2CO3溶液中通一定量的CO2气体后,溶液中一定存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | Na2CO3溶液加水稀释后,c(H+)增大 | |
| D. | Na2CO3溶液中加入过量HCN,反应方程式为:Na2CO3+HCN=NaHCO3+NaCN |
分析 A.Na2CO3溶液中滴入等体积、等浓度的盐酸后,二者恰好反应生成碳酸氢钠和NaCl,任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.Na2CO3溶液加水稀释后,促进碳酸根离子水解,溶液中氢氧根离子个数增大,但氢氧根离子物质的量的增大倍数小于溶液体积增大倍数,导致氢氧根离子浓度减小;
D.酸性强弱H2CO3>HCN>HCO3-,所以HCN和碳酸根离子反应生成CN-、HCO3-.
解答 解:A.Na2CO3溶液中滴入等体积、等浓度的盐酸后,二者恰好反应生成碳酸氢钠和NaCl,任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-),故A正确;
B.任何电解质溶液中都存在物料守恒,因为溶液中通入一定量二氧化碳,碳酸钠和二氧化碳、水反应生成碳酸氢钠,导致溶液中C元素存在的微粒物质的量增大,所以溶液中存在c(Na+)<c(H2CO3)+c(HCO3-)+c(CO32-),故B错误;
C.Na2CO3溶液加水稀释后,促进碳酸根离子水解,溶液中氢氧根离子个数增大,但氢氧根离子物质的量的增大倍数小于溶液体积增大倍数,导致氢氧根离子浓度减小,温度不变水的离子积常数不变,所以c(H+)增大,故C正确;
D.酸性强弱H2CO3>HCN>HCO3-,所以HCN和碳酸根离子反应生成CN-、HCO3-,则Na2CO3溶液中加入过量HCN,反应方程式为:Na2CO3+HCN=NaHCO3+NaCN,故D正确;
故选B.
点评 本题考查离子浓度大小比较,明确溶液中的溶质及溶液酸碱性是解本题关键,知道酸性强弱与离子反应关系,易错选项是B,注意通入二氧化碳导致C元素含量增大,为易错点.

| A. | H2 | B. | CO | C. | C12H22O11 | D. | C6H12O6 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
| A. | 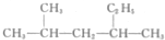 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. |  互为同分异构体 互为同分异构体 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
| A. | 研发易降解的生物农药符合十八大报告中提到的生态文明建设 | |
| B. | 熟吃西红柿要比生吃维生素C的损失小 | |
| C. | 教育部发出禁令是因为吸烟也会产生多种有害有毒物质 | |
| D. | 大量焚烧田间秸秆会产生雾霾而影响空气质量 |
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
 )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |