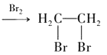题目内容
【题目】将11.9g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g。另取等质量的合金溶于过量稀硝酸中,生成了6.72LNO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
A.22.1gB.27.2gC.30gD.30.2g
【答案】B
【解析】
将合金加入热氢氧化钠溶液中,铝发生反应,减少的质量就是铝的质量,n(Al)=![]() =
=![]() =0.1mol,m(氢氧化铝)=n(氢氧化铝)×M=0.1mol×78g∕mol=7.8g;n(NO)总=0.3mol.根据方程式Al+4HNO3=Al(NO3)3+NO↑+2H2O可知铝放出NO气体0.1mol.镁和铝放出的一氧化氮为0.3-0.1=0.2mol.镁和铝质量和为11.9-2.7=9.2g,根据3Mg+8HNO3=3Mg(NO3)2+2NO↑+4H2O,Fe+4HNO3=Fe(NO3)3+NO↑+2H2O就可以求出各自的质量,进而求出它们转化得到的沉淀的质量。
=0.1mol,m(氢氧化铝)=n(氢氧化铝)×M=0.1mol×78g∕mol=7.8g;n(NO)总=0.3mol.根据方程式Al+4HNO3=Al(NO3)3+NO↑+2H2O可知铝放出NO气体0.1mol.镁和铝放出的一氧化氮为0.3-0.1=0.2mol.镁和铝质量和为11.9-2.7=9.2g,根据3Mg+8HNO3=3Mg(NO3)2+2NO↑+4H2O,Fe+4HNO3=Fe(NO3)3+NO↑+2H2O就可以求出各自的质量,进而求出它们转化得到的沉淀的质量。
根据上述分析可知,n(Mg)=0.15mol,n(Fe)=0.1mol.Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量=0.15mol×58g∕mol+0.1mol×78g∕mol+0.1mol×107g∕mol=27.2g,选项为:B。

 名校课堂系列答案
名校课堂系列答案【题目】向乙酸、乙醇、乙酸乙酯和水的平衡体系中加入少量含有18O的![]() ,达到新平衡后,体系中含有18O的物质是
,达到新平衡后,体系中含有18O的物质是
A. 乙酸、乙醇 B. 乙醇、乙酸乙酯
C. 乙醇、乙酸乙酯和水 D. 乙酸、乙醇、乙酸乙酯和水
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D