题目内容
【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)

①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
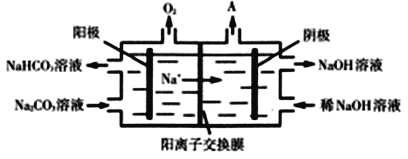
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。
【答案】 -66kJ/mol < 温度 温度较低时,温度越高,速率越快,转化率逐渐增大;温度较高时,由于两反应均为放热反应,温度越高,平衡逆移,转化率越低(其它答案合理也可) ABE 625V2/m2 0.198m 4CO32-+2H2O-4e-==4HCO3-+O2↑
【解析】(1)反应热=反应物总键能生成物总键能, △H2=(2×750+436)kJmol1(1076 kJmol1+2×463 kJmol1)= -66kJ/mol 答案为:-66kJ/mol
(2)①由图Ⅰ可知,反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故△H1<0;由图II可知,催化剂的选择性受到温度的影响。②CO2的转化率先增大是反应正向进行未达平衡状态,达到平衡状态后升高温度,由于反应I和II都是放热反应,平衡向逆反应方向移动,导致CO2的转化率降低。③A.提高原料气中H2所占比例,有利于平衡正向移动,增大CO2的转化率,A正确;B.适当增大压强,反应I正向移动,反应II无影响,可导致CO2的转化率增大,B正确;C. 反应I和II都是放热反应,升高温度平衡逆向移动,导致CO2的转化率减小,C错误;D.催化剂不影响平衡的移动,不影响CO2的转化率,D错误;E.前段加热,反应速率加快,有利于增大CO2的转化率,后段冷却平衡正向移动,CO2的转化率增大,E正确。
④根据图I 350℃时CO2的平衡转化率为0.8,三段式进行计算
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
初n 0.2m 0.8m 0 0
转化n 0.2m ×0.8 0.2m ×0.8×4 0.2m×0.8 0.2m ×0.8×2
平衡n 0.2m ×0.2 0.2m×0.8 0.2m ×0.8 0.2m ×1.6
代入求平衡常数K=[ 0.2m×0.8×(0.2m ×1.6)2×![]() ] /[ 0.2m ×0.2×(0.2m×0.8)4×
] /[ 0.2m ×0.2×(0.2m×0.8)4×![]() ]=625V2/m2
]=625V2/m2
⑤根据图I可知550℃时CO2的平衡转化率为0.6,根据图II可知,转化的CO2有65%生成CH4,有35%生成CO,根据反应I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g)、II. CO2 (g)+H2(g)
CH4(g)+2H2O(g)、II. CO2 (g)+H2(g) ![]() CO(g)+H2O(g)这两个方程式可得:550℃时,达到平衡,此时容器中H2O(g)的物质的量为:0.2m ×0.6×65%×2+0.2m ×0.6×35%=0.198m。答案为:①< 、 温度②温度较低时,温度越高,速率越快,转化率逐渐增大;温度较高时,由于两反应均为放热反应,温度越高,平衡逆移,转化率越低(其它答案合理也可) ③ ABE ④ 625V2/m2 (单位可写可不写) ⑤0.198m
CO(g)+H2O(g)这两个方程式可得:550℃时,达到平衡,此时容器中H2O(g)的物质的量为:0.2m ×0.6×65%×2+0.2m ×0.6×35%=0.198m。答案为:①< 、 温度②温度较低时,温度越高,速率越快,转化率逐渐增大;温度较高时,由于两反应均为放热反应,温度越高,平衡逆移,转化率越低(其它答案合理也可) ③ ABE ④ 625V2/m2 (单位可写可不写) ⑤0.198m
(3)阳极发生氧化反应,水中的氢氧根离子失去电子生成氢离子和氧气,氢离子与碳酸根离子结合生成碳酸氢根离子,电极反应式为4CO32-+2H2O-4e-==4HCO3-+O2↑答案为:4CO32-+2H2O-4e-==4HCO3-+O2↑