题目内容
【题目】下列电离方程式书写正确的是( )
A.H2SO4═H22++SO42﹣
B.NaHCO3═Na++H++CO32﹣
C.NaOH═Na++O2﹣+H+
D.Na2SO4═2Na++SO42﹣
【答案】D
【解析】解:A.硫酸为强电解质,完全电离,电离方程式:H2SO4═2H++SO42﹣ , 故A错误;
B.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3﹣ , 故B错误;
C.氢氧化钠为强电解质,完全电离,电离方程式:NaOH═Na++OH﹣ , 故C错误;
D.硫酸钠为强电解质,完全电离,电离方程式:Na2SO4═2Na++SO42﹣ , 故D正确;
故选:D.

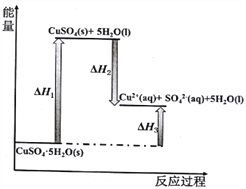
【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)

①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
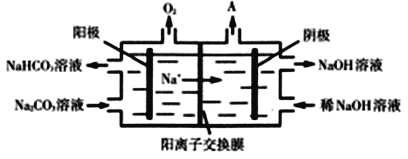
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。