题目内容
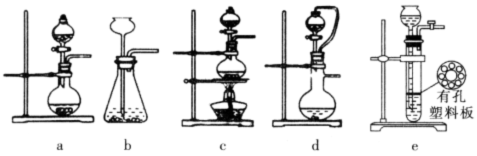
现有如下仪器,仪器中已注入溶液,回答下列问题。
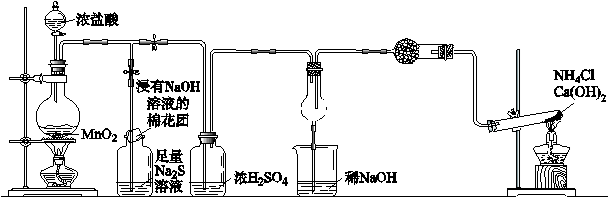
(1)加热装置A,写出铜与浓硫酸反应的化学方程式: ,烧瓶中的实验现象为 。
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂分别为 、 、 。能说明碳的非金属性比硅强的实验现象是 。
(3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。
①则证明SO2有氧化性的实验现象是 ,反应方程式为:
。
②若证明SO2具有还原性,在E中采取的实验操作为 ,其实验现象为 ,反应原理为 。
(1)Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O; 1分
CuSO4+SO2↑+2H2O; 1分
铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成 2分
(2)B:Na2CO3溶液或 NaHCO3 溶液 C:KMnO4溶液 D:Na2SiO3溶液 ;
C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。 各1分,共4分
(3)①H2S溶液中有浅黄色混浊出现 2H2S+SO2=3S↓+2H2O 各1分共2分
②通入氯气或加入氯水或加入过氧化氢溶液,或高锰酸钾溶液等氧化剂(其中一种或其它合理答案均可);现象是有白色沉定生成。 各1分共2分
根据所加入试剂写出方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl? 2分
解析

某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.
①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠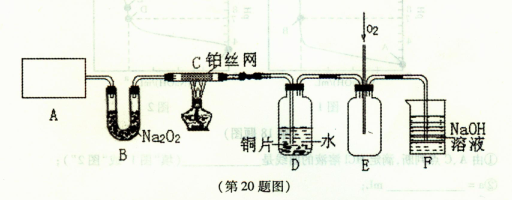
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是 (填物质序号)
(2)B装置的作用为
(3)D中铜片发生反应的离子方程式为 ,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的 (填下列各项序号)
| A.Na2CO3 | B.AgNO3 | C.H2SO4 | D.FeSO4 |
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见: 。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为________。
(2)装置B中饱和食盐水的作用是________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:__________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________该现象________(填“能”或“不能”)说明溴的非金属性强于碘,原因是__________________________。
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:__________________。请判断改用NaHSO3溶液是否可行?________(填“是”或“否”)。
某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
| 实验 序号 | 称取CuSO4 的质量/g | 碱石灰的 增加质量/g | 剩余气体的体积(折算 成标准状况下)/mL | 结论 |
| Ⅰ | 6.4 | | | 假设1成立 |
| Ⅱ | 6.4 | 2.88 | 224 | |
| Ⅲ | 6.4 | 2.56 | 448 | |
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。
Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过 、 、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 (用离子方程式表示)。
②Ⅳ中,操作步骤是 、 。
③装置B中盛放的试剂是(填化学式) 溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 | | | | |
| 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
则判断达到滴定终点的现象是 ,废水中Ba2+的物质的量浓度 _。