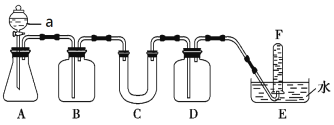
题目内容
【题目】制烧碱所用的盐水需进行两次的精制。
(1)第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
I.向粗盐水中加入过量X,过滤。
II.向所得滤液中加入过量Y,过滤。
III.滤液用盐酸调节pH,获得一次精制盐水。
请回答下列问题:
①X是__________。
②Y是___________,加入Y的主要目的_______________。
③经检测,II中过滤所得的沉淀中还含有Mg2(OH)2CO3,生成该沉淀的离子方程式是________。
(2)第二次精制要除去一次精制盐水中微量的IO3-、NH4+、Ca2+、Mg2+,流程示意图如下:
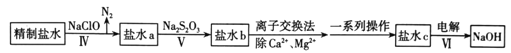
①IV中除去的离子是____________(填化学式),判断的理由是_______。
②V中得到的溶液颜色呈棕黄色,由此说明Na2S2O3将IO3-还原为______(填化学式),同时Na2S2O3被氧化为SO42-。此反应中体现了Na2S2O3的_________性。假设Na2S2O3已完全反应,则证明盐水b中含有SO42-的方法是__________,观察到的现象是____________。
③有同学提出,该流程中的过程IV可直接加入NaOH溶液除去NH4+和Mg2+,你认为是否可行?_______(填“是”或“否”,提示NH3极易溶于水),理由是_______(答一点)。
【答案】BaCl2溶液 Na2CO3溶液 除去溶液中的Ca2+、Ba2+ 2Mg2++2 OH-+ CO32-= Mg2(OH)2CO3↓ NH4+ 过程IV中生成了氮气,只有NH4+中含有N元素 I2 还原 取少量盐水b,向其中加入氯化钡溶液 产生白色沉淀 否 氢氧化钠与NH4+反应生成的NH3极易溶于水,不易除去
【解析】
(1)除去粗盐水中的Ca2+、Mg2+及SO42-,加入NaOH溶液是除去镁离子,加BaCl2溶液是除去硫酸根离子,加Na2CO3溶液是除去钙离子和过量的钡离子,因此,Na2CO3溶液一定在BaCl2溶液之后加入,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸,结合③中的提示分析解答;
(2)①根据流程图,IV中加入次氯酸钠反应后生成了氮气,据此分析判断;②V中得到的溶液颜色呈棕黄色,生成了碘单质,结合氧化还原反应的规律和SO42-的检验方法分析解答;③根据氨气极易溶于水分析判断。
(1)除去粗盐水中的Ca2+、Mg2+及SO42-,加入NaOH溶液是除去镁离子,加BaCl2溶液是除去硫酸根离子,加Na2CO3溶液是除去钙离子和过量的钡离子,因此,Na2CO3溶液一定在BaCl2溶液之后加入,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸。
①结合③中II中过滤所得的沉淀中还含有Mg2(OH)2CO3,因此X不是氢氧化钠,也不是Na2CO3,则X为BaCl2溶液,故答案为:BaCl2溶液;
②I中除去了SO42-,滤液中还含有,Ca2+、Mg2+和过量的Ba2+,可以加入Na2CO3溶液除去Ca2+和过量的Ba2+,故答案为:Na2CO3溶液;除去溶液中的Ca2+、Ba2+;
③II中过滤所得的沉淀中还含有Mg2(OH)2CO3,生成该沉淀的离子方程式为2Mg2++2 OH-+ CO32-= Mg2(OH)2CO3↓,故答案为:2Mg2++2 OH-+ CO32-= Mg2(OH)2CO3↓;
(2)①根据流程图,IV中加入次氯酸钠反应后生成了氮气,说明除去的离子是NH4+,因为只有NH4+中含有N元素,故答案为:NH4+;过程IV中生成了氮气,只有NH4+中含有N元素;
②V中得到的溶液颜色呈棕黄色,生成了碘单质,说明Na2S2O3将IO3-还原为I2,同时Na2S2O3被氧化为SO42-。此反应中Na2S2O3中S元素由+2价升高到+6价,体现了Na2S2O3的还原性。假设Na2S2O3已完全反应,只需要加入氯化钡溶液,若生成白色沉淀,即可证明盐水b中含有SO42-,故答案为:I2;还原;取少量盐水b,向其中加入氯化钡溶液;产生白色沉淀;
③若直接加入NaOH溶液除去NH4+和Mg2+,氢氧化钠与铵根反应生成的氨气,极易溶于水,不能完全除去,故答案为:否;氢氧化钠与NH4+反应生成的NH3极易溶于水,不易除去。