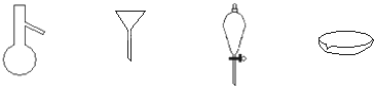题目内容
【题目】二氯化二硫(S2C12)是工业上常用的硫化剂。常温下是一种液体,沸点137℃,易与水反应。实验室可通过硫与少量氯气在110140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
(1)选取以下装置制取少量S2Cl2:

①仪器m的名称为_____________。
②装置连接顺序:A→________________________________→E→D。
③A中发生反应的离子方程式为 _________________________。
④装置F的作用是____________________。
⑤D中的最佳试剂是__________(填标号)。
a.碱石灰 b.浓硫酸 c.无水氯化钙
⑥为了提高S2Cl2的纯度,关键的是控制好温度和_______________________。
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合物的SO2的体积分数。

①W溶液可以是下列溶液中的__________(填标号);
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为__________(含V、m的代数式表示)。
【答案】 冷凝管 FCB MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 吸收HCl气体 a 通入氯气的量(或浓盐酸滴下速率) ac
Mn2++2H2O+Cl2↑ 吸收HCl气体 a 通入氯气的量(或浓盐酸滴下速率) ac ![]() ×100%
×100%
【解析】本题考查实验方案设计与评价,(1)①仪器m为冷凝管;②装置A为制取氯气装置,产生的氯气中混有HCl和水蒸气,先除去HCl,因此A连接F,S2Cl2易于水反应,因此需要除去中氯气中的水蒸气,F连接C,从C中出来的气体为纯净的氯气,直接通入到反应装置中,即C连接B,S2Cl2为液体,沸点为137℃,因此B连接E装置,氯气有毒,必须有尾气处理装置,即E连接D装置;③发生的离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;④装置F的作用是除去HCl;⑤装置D的作用是除去过量的氯气,防止污染空气,因此装置D中的试剂为a;⑥氯气过量则会生成SCl2,因此需要控制氯气的量;(2)①根据流程的目的,需要把SO2转化成SO42-,然后加入Ba2+,产生BaSO4沉淀,测BaSO4的质量,因此W溶液具有的性质为氧化性,由于高锰酸钾与HCl反应得到有毒物质氯气,因此W溶液为ac;②固体为BaSO4,根据硫元素守恒,即n(SO2)=n(BaSO4)=m/233mol,因此SO2的体积分数为:
Mn2++Cl2↑+2H2O;④装置F的作用是除去HCl;⑤装置D的作用是除去过量的氯气,防止污染空气,因此装置D中的试剂为a;⑥氯气过量则会生成SCl2,因此需要控制氯气的量;(2)①根据流程的目的,需要把SO2转化成SO42-,然后加入Ba2+,产生BaSO4沉淀,测BaSO4的质量,因此W溶液具有的性质为氧化性,由于高锰酸钾与HCl反应得到有毒物质氯气,因此W溶液为ac;②固体为BaSO4,根据硫元素守恒,即n(SO2)=n(BaSO4)=m/233mol,因此SO2的体积分数为:![]() ×100%。
×100%。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】I.现用下图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。请回答下列问题:

(1)b电极材料为__________,其电极反应式为_________________________。
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为__________,此时a电极质量减少__________g。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有:________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有___________________(答两种);
(4)为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4 /mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液 /mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O /mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V3=____________, V8=______________;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________。
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=________________________(忽略反应前后溶液体积变化)。
p>【题目】下列四个前面现象和后面解释不正确的是
A | 正常雨水的PH为5.6 | 是因为溶解了二氧化碳的缘故 |
B | 汽车尾气中含有NO | 是因为在内燃机中产生高温下氮气与氧气发生反应 |
C | 氯水能使紫色石蕊试液先变红后褪色 | 是因为氯气与水反应产生了盐酸和次氯酸 |
D | FeS晶体硬度很大 | 是因为Fe与S形成了合金 |
A. A B. B C. C D. D