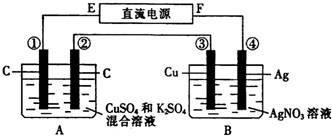
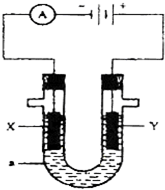
题目内容
工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行.第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4.试回答以下问题:
(1)制取K2MnO4的MnO2是这一氧化还原反应的______剂(填“氧化”或“还原”),连续搅拌的目的是______.
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是______,
阳极是______,
电解总的反应方程式是______.
(1)制取K2MnO4的MnO2是这一氧化还原反应的______剂(填“氧化”或“还原”),连续搅拌的目的是______.
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是______,
阳极是______,
电解总的反应方程式是______.
(1)根据化合价变化,MnO2化合价有+4价被氧化成K2MnO4的+6价,化合价升高被氧化,作还原剂;将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,二氧化锰能够与空气充分接触,使MnO2氧化完全,
故答案为:还原剂;与空气充分接触,使MnO2氧化完全;
(2)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,总方程式为:2MnO42-+2H2O=2MnO4-+H2↑+2OH-,
故答案为:2H2O+2e-=H2↑+2OH-;MnO42--e-=MnO4-;2MnO42-+2H2O=2MnO4-+H2↑+2OH-.
故答案为:还原剂;与空气充分接触,使MnO2氧化完全;
(2)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,总方程式为:2MnO42-+2H2O=2MnO4-+H2↑+2OH-,
故答案为:2H2O+2e-=H2↑+2OH-;MnO42--e-=MnO4-;2MnO42-+2H2O=2MnO4-+H2↑+2OH-.

练习册系列答案
相关题目

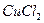 溶液,加入水
溶液,加入水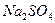 溶液,加入水
溶液,加入水 溶液,加入
溶液,加入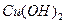 固体
固体