题目内容
15.在某温度时,测得纯水的c(H+)=2.4×10-7mol•L-1,则c(OH-)为( )| A. | $\frac{1.0×1{0}^{-14}}{2.4×1{0}^{-7}}$mol•L-1 | B. | 0.1×10-7 mol•L-1 | ||
| C. | 2.4×10-7 mol•L-1 | D. | c(OH-)无法确定 |
分析 当溶液中c(H+)=c(OH-),则溶液呈中性,当溶液中c(H+)>c(OH-),则溶液呈酸性,当溶液中c(H+)<c(OH-),则溶液呈碱性.
解答 解:纯水呈中性,则纯水中c(H+)=c(OH-)=2.4×10-7 mol/L,故选C.
点评 本题考查弱电解质的电离及溶液酸碱性的确定,注意不能根据c(H+) 大小确定溶液是酸碱性,要根据c(H+) 和c(OH-)的相对大小确定溶液的酸碱性,为易错点.

练习册系列答案
相关题目
5.同温同压下等质量的SO2和CO2相比较,下列各项正确的是( )
| A. | 原子个数之比为1:1 | B. | 物质的量之比为1:1 | ||
| C. | 体积之比为11:16 | D. | 分子数之比为1:1 |
6.下列反应中,不属于氧化还原反应的( )
| A. | NO+NO2+2NaOH=2NaNO2+H2O | B. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | CuO+2HNO3═Cu(NO3)2+H2O | D. | 2FeCl2+Cl2=2FeCl3 |
10.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
20.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质:①是溶液,②是胶体,③能产生丁达尔效应,④能透过滤纸,⑤能透过半透膜,⑥静置后,会析出黑色沉淀,叙述正确的是( )
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
5.下列实验一定能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 在食盐水中通入氟气置换出氯气 | 证明氟的非金属性强于氯 |
| B | 将滴有酚酞试液的氨水分成两份,并加热其中一份溶液 | 研究温度对弱电解质电离的影响 |
| C | 分别用玻璃棒蘸c(H+)相同的乙二酸和乙酸溶液,点在pH试纸上,并与标准比色卡对比 | 比较乙二酸和乙酸的酸性强弱 |
| D | 室温下,分别向体积、浓度均相同的Na2S2O3溶液中加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
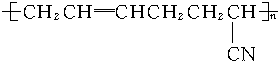 ,则这种高分子化合物的单体的结构简式是CH2=CHCH=CH2、CH2=CHCN.
,则这种高分子化合物的单体的结构简式是CH2=CHCH=CH2、CH2=CHCN.