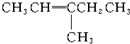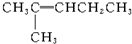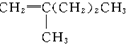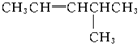题目内容
7.向30克7.5%的碘化钠溶液中,通入一定量的氯气,完全反应后蒸干,并加热至质量不变,得到1.75克固体物质,计算有多少克氯气参加反应?(结果保留三位有效数字)分析 发生反应:2NaI+Cl2=2NaCl+I2,整个过程中碘发生升华,根据固体质量变化,利用差量法计算参加反应的氯气的质量.
解答 解:NaI的质量=30g×7.5%=2.25g,
令参加反应的氯气质量为xg,则:
2NaI+Cl2=2NaCl+I2 固体质量减少
71 254 254-71=x183
xg 2.25g-1.75g=0.5g
所以$\frac{71}{183}=\frac{x}{0.5}$
解得x=0.194,
答:参加反应的氯气为0.194g.
点评 本题考查化学方程式的有关计算,难度中等,注意利用差量法计算,避免判断蒸干后固体产物组成,注意碘的升华性质.

练习册系列答案
相关题目
17.某溶液中含有大量的Cl-、CO32-、OH-,如果只取一次该溶液分别将三种离子检验出来,下列添加试剂的顺序正确的是( )
| A. | 先加Mg(NO3)2,再加Ca(NO3)2,最后加AgNO3 | |
| B. | 先加Ca(NO3)2,再加AgNO3,最后加Mg(NO3)2 | |
| C. | 先加AgNO3,再加Ca(NO3)2,最后加Mg(NO3)2 | |
| D. | 先加Ca(NO3)2,再加Mg(NO3)2,最后加AgNO3 |
18.工业上制取金刚沙(SiC)的反应为:SiO2+3C→SiC+2CO↑,其中氧化剂与还原剂的质量比为( )
| A. | 60:36 | B. | 36:60 | C. | 2:1 | D. | 1:2 |
15.在某温度时,测得纯水的c(H+)=2.4×10-7mol•L-1,则c(OH-)为( )
| A. | $\frac{1.0×1{0}^{-14}}{2.4×1{0}^{-7}}$mol•L-1 | B. | 0.1×10-7 mol•L-1 | ||
| C. | 2.4×10-7 mol•L-1 | D. | c(OH-)无法确定 |
19.新型合成弹性材料的结构简式如下: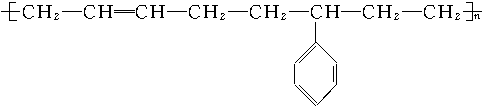 合成此种弹性材料的单体有( )
合成此种弹性材料的单体有( )
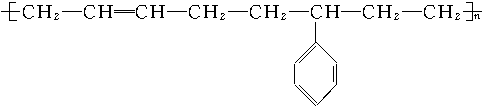 合成此种弹性材料的单体有( )
合成此种弹性材料的单体有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |

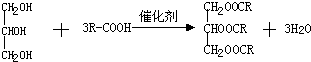 ;
; ;
;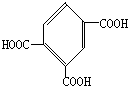 .
.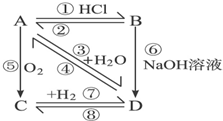 如图所示,各步反应的最后产物D是一种饱和一元醇,其蒸气密度是相同状况下H2密度的23倍,试回答下列问题:
如图所示,各步反应的最后产物D是一种饱和一元醇,其蒸气密度是相同状况下H2密度的23倍,试回答下列问题: CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O
CH2═CH2↑+H2O,⑥CH3CH2Cl+H2O CH3CH2OH+HCl,⑦CH3CHO+H2
CH3CH2OH+HCl,⑦CH3CHO+H2 CH3CH2OH,⑧2CH3CH2OH+O2
CH3CH2OH,⑧2CH3CH2OH+O2 2CH3CHO+2H2O.
2CH3CHO+2H2O.