题目内容
【题目】乙烯是重要的化工原料,用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H<0
C2H4(g)+4H2O(g) △H<0
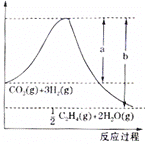
(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=_______kJ/mol (用含a、b的式子表示)
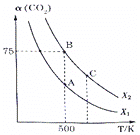
(2)向1L容密闭容器中通入1 mol CO2和nmol H2,在一定条件下发生上述反应,测得CO2的转化率a(CO2)与反应温度、投料比X[![]() ]的关系如图所示。
]的关系如图所示。
①X1_______X2(填“>”“<”或“=”,下同),平衡常数Ka____Kb____Kc。
②若B点时X=3,则平衡常数Kb=__________(代入数据列出算式即可)。
③下列措施能同时满足增大反应速率和提髙CO2转化率的是______________。
a.升高温度 b.加入催化剂 c.增大投料比X d.增加压强
e.将产物从反应体系中分离出来
(3)乙烯也可作为制备甲酸的基础工业原料,常温时,HCOOH的电离平衡常数Ka=1.8×l0-4mol·L-1,pH=12的HCOONa和含少量NaOH混合溶液中。
①书写HCOONa的水解离子反应方程式_________________。
②该溶液中离子浓度关系:  =_________mol·L-1
=_________mol·L-1
③若0. lmol/L的HCOONa溶液中加入等体积的0.09mol/LHCOOH,配制了pH=6.8的溶液,则该溶液中微粒浓度由小到大的顺序为________________。(不考虑水分子)
【答案】 -2(b-a)或2(a-b) < = > ![]() c d HCOO- +H2O=HCOOH+OH- 1.8×106 c(OH-)<c(H+) <c (HCOOH) <c(Na+) <c (HCOO-)
c d HCOO- +H2O=HCOOH+OH- 1.8×106 c(OH-)<c(H+) <c (HCOOH) <c(Na+) <c (HCOO-)
【解析】(1)焓变等于生成物总能量减去反应物的总能量,所以由图可知,反应CO2(g)+3H2(g)![]()
![]() C2H4(g)+2H2O △H=-(b-a)kJ/mol,故反应2CO2(g)+6H2(g)
C2H4(g)+2H2O △H=-(b-a)kJ/mol,故反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O △H=-2(b-a)kJ/mol;(2)①相同条件下,投料比越大,二氧化碳的转化率越大,根据图知,相同温度下X2的转化率大于X1,所以X1<X2;该反应正反应是放热反应,温度越高,其平衡常数越小,温度C>A=B,则平衡常数Ka=Kb>Kc;②若B点的投料比是3,X[
C2H4(g)+4H2O △H=-2(b-a)kJ/mol;(2)①相同条件下,投料比越大,二氧化碳的转化率越大,根据图知,相同温度下X2的转化率大于X1,所以X1<X2;该反应正反应是放热反应,温度越高,其平衡常数越小,温度C>A=B,则平衡常数Ka=Kb>Kc;②若B点的投料比是3,X[![]() ]=3,向1L容密闭容器中通入1 mol CO2和nmol H2,则n=3,CO2的转化率a(CO2)=75%,
]=3,向1L容密闭容器中通入1 mol CO2和nmol H2,则n=3,CO2的转化率a(CO2)=75%,
2CO2(g)+6H2(g)![]() C2H4(g)+4H2O (g)
C2H4(g)+4H2O (g)
开始时的浓度(mol/L) 1 3 0 0
改变的浓度(mol/L) 0.75 2.25 0.375 1.5
平衡时的浓度(mol/L) 0.25 0.75 0.375 1.5
则平衡常数Kb= =
=![]() ;③反应2CO2(g)+6H2(g)
;③反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O △H<0正反应是气体体积缩小的放热反应,a.升高温度,化学反应速率增大,平衡向逆反应方向移动,CO2转化率降低,选项a不选;b.加入催化剂,化学反应速率增大,平衡不移动,CO2转化率不变,选项b不选;c.增大投料比X,反应物H2的浓度增大,反应速率增大,平衡向正反应方向移动,且CO2转化率转化率增大,选项c选;d.增加压强,化学反应速率增大,平衡向正反应方向移动,CO2转化率转化率增大,选项d选;答案选cd;(3)①HCOONa为强碱弱酸盐,水解显碱性,水解离子反应方程式为:HCOO- +H2O=HCOOH+OH-;②pH=12时,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,Ka=
C2H4(g)+4H2O △H<0正反应是气体体积缩小的放热反应,a.升高温度,化学反应速率增大,平衡向逆反应方向移动,CO2转化率降低,选项a不选;b.加入催化剂,化学反应速率增大,平衡不移动,CO2转化率不变,选项b不选;c.增大投料比X,反应物H2的浓度增大,反应速率增大,平衡向正反应方向移动,且CO2转化率转化率增大,选项c选;d.增加压强,化学反应速率增大,平衡向正反应方向移动,CO2转化率转化率增大,选项d选;答案选cd;(3)①HCOONa为强碱弱酸盐,水解显碱性,水解离子反应方程式为:HCOO- +H2O=HCOOH+OH-;②pH=12时,c(H+)=10-12mol/L,c(OH-)=10-2mol/L,Ka=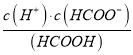 =1.8×l0-4mol·L-1,
=1.8×l0-4mol·L-1, 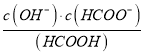 =
=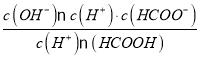 =
=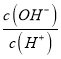 ×Ka=
×Ka=![]()