题目内容
【题目】如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是
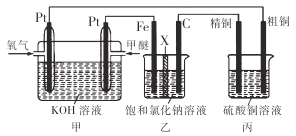
A. 乙装置中铁电极为阴极,电极反应式为Fe-2e-=Fe2+
B. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
C. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
D. 通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O=4OH-
【答案】B
【解析】因燃料在反应中失电子发生氧化反应,氧气在反应中得电子发生还原反应,故通入燃料的电极是负极,通入氧气的电极是正极,则甲为原电池,乙和丙为电解池。
A.乙装置中Fe电极连接甲装置中的负极,所以Fe为阴极,阴极受保护,故Fe不能发生反应,故A错误;
B.乙装置中的Fe电极为阴极,发生的电极反应为:2H2O+2e-=H2↑+2OH-,所以反应一段时间后,Fe电极附近生成NaOH,故B正确;
C.因粗铜中含有Zn、Fe等活泼性比铜强的金属,所以开始电解时,阳极发生的是Zn、Fe等失电子的反应,阴极发生的是铜离子得电子生成单质铜的反应,此时溶液中的硫酸铜浓度会减少,故C错误;
D.根据上述分析可知,通入氧气的电极是正极,氧气在反应中得电子,发生的反应是O2+4e-+2H2O=4OH-,故D错误;
故答案选B。

练习册系列答案
相关题目






