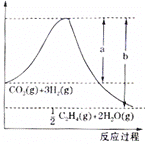
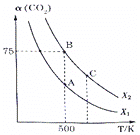
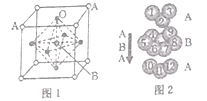
题目内容
【题目】有共价键的离子化合物是( )
A.NaClB.H2O2C.C2H5BrD.K2SO4
【答案】D
【解析】
A. NaCl由活泼金属与活泼非金属组成,为离子化合物,组成中不含原子团,不含共价键;A不符合题意;
B. H2O2是由非金属元素组成的共价化合物,B不符合题意;
C. C2H5Br为不能电离的有机物,是共价化合物,C不符合题意;
D. K2SO4是由活泼金属与酸根离子组成的盐,是离子化合物,酸根离子为原子团,含共价键,D符合题意。
答案选D。

练习册系列答案
相关题目