题目内容
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为________________________;
(2)写出与H2O分子互为等电子体的微粒___________________(填1种即可)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________________
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
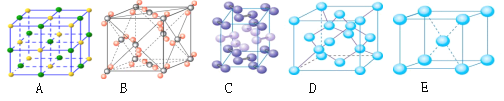
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是___________________(请用相应的编号填写)
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:____________________________________________。
【答案】 1s22s22p4 H2S或NH2- A BC 20 Cu2++4H2O=[Cu(H2O)4]2+
【解析】分析:(1)根据核外电子排布规律书写;
(2)原子数和价电子数分别都相等的微粒为等电子体;
(3)根据水分析以及水合氢离子中含有的化学键类型、空间构型判断;
(4)根据冰是分子晶体判断;
(5)根据升华热=范德华力+氢键判断;
(6)根据铜离子能与水分子形成配位键分析。
详解:(1)氧原子的核电荷数是8,根据构造原理可知外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,所以水分子中氧原子在基态时核外电子排布式为1s22s22p4。
(2)水分子含有3个原子、8个价电子,因此与水互为等电子体的微粒有H2S、NH2-。
(3)A、水分子中氧原子含有2个共价单键和2个孤电子对,其空间构型是V型,所以水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,A错误;
B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,B正确;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,C正确;
D、水分子为V型,键角是104.5°,H3O+为三角锥型,微粒中的键角发生了改变,D正确,答案选A;
(4)冰属于分子晶体,根据微粒的晶胞结构特点可知,A是离子晶体氯化钠的晶胞,构成微粒是离子。B为干冰的晶胞图,构成微粒为分子,属于分子晶体。C为碘的晶胞图,构成微粒为碘分子,所以分子晶体;D是原子晶体金刚石的晶胞,构成微粒是原子。E是金属晶体钠的晶胞,构成微粒是金属阳离子和自由电子,则与冰的晶体类型相同的是干冰和碘单质,答案选BC。
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则根据结构图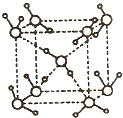 可知,1mol水中含有2mol氢键,升华热=范德华力+氢键。由于冰的升华热是51kJ/mol,水分子间的范德华力是11kJ/mol,所以冰晶体中氢键的“键能”是(51kJ/mol-11kJ/mol)÷2=20kJ/mol。
可知,1mol水中含有2mol氢键,升华热=范德华力+氢键。由于冰的升华热是51kJ/mol,水分子间的范德华力是11kJ/mol,所以冰晶体中氢键的“键能”是(51kJ/mol-11kJ/mol)÷2=20kJ/mol。
(6)无水硫酸铜溶于水后生成水合铜离子,铜离子提供空轨道,水分子中的氧原子提供孤电子对,形成配位键,则生成此配合离子的离子方程式Cu2++4H2O=[Cu(H2O)4]2+。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案