题目内容
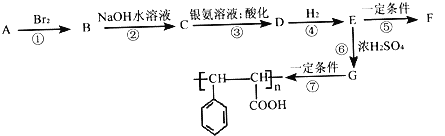
【题目】常温下,向20 mL 0.1mol/L的K2CO3溶液中逐滴加入0.1mol/L的稀盐酸40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
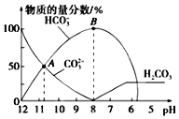
A. 随着稀盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变
B. 根据A点计算,Ka2(H2CO3)的数量级为10-3
C. B点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
【答案】A
【解析】
A.c(HCO3-)·c(OH-)/c(CO32-)=c(HCO3-)·c(OH-)·c(H+)/c(CO32-)·c(H+)=Kw/Ka2,平衡常数不随浓度变化,随着盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变,A正确;
B.A点溶液中c(CO32-)=c(HCO3-),pH≈11,即氢离子浓度约是10-11mol/L,则Ka2=c(CO32-)·c(H+)/c(HCO3-)=c(H+)≈10-11mol/L,即Ka2(H2CO3)的数量级为10-11,B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得B点所处的溶液中c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),C错误;
D.根据图像可知pH=6时,氢离子与碳酸氢根离子反应有CO2气体逸出,当pH约为8时,恰好转化为碳酸氢钾,D错误。
答案选A。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]
①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O
(1)装置A中反应的化学方程式为________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→____________。(填字母编号,装置不重复使用)
(3)实验中滴加稀盐酸的操作为____________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是____________________;装置F的作用为_____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:___________________________________________。
②为了证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
______________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |