题目内容
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则此反应中氧化剂与还原剂的物质的量之比是( )
A.21∶5B.11∶3C.4∶1D.1∶4
【答案】C
【解析】
在氧化还原反应中,氧化剂与还原剂的得失电子总数相等,ClO-与ClO3-的物质的量浓度之比为1∶3时,设所得溶液中ClO-为1mol、ClO3-为3mol,则还原剂失去电子16mol,所以应有16mol的0价Cl原子变为氯离子,作氧化剂的氯原子为16,作还原剂的氯原子为4,其比值为4:1;
答案为C。

练习册系列答案
相关题目
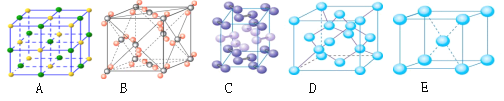
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,最易失电子的元素是________,非金属性最强的元素是______;
(2)化学性质最不活泼的元素是_____,其原子的原子结构示意图为________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是____,碱性最强的是___,呈两性的氢氧化物是_______________;(填写化学式)
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5在⑦与⑩的单质中,氧化性较强的是_______________,用反应化学方程式证明:_____________________________。