题目内容
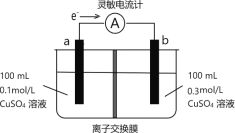
【题目】按如图所示装置进行实验,观察到灵敏电流计指针偏转,图中a、b电极均为铜单质,下列说法正确的是( )
A.该装置的能量转换形式为:电能→化学能
B.b的电极反应为:Cu-2e-=Cu2+
C.溶液中SO![]() 穿过阴离子交换膜发生迁移
穿过阴离子交换膜发生迁移
D.外电路转移的电子最多为0.01mol
【答案】C
【解析】
根据电子流向可知a电极为负极,b电极为正极;所以该电池是由于CuSO4溶液浓度不同形成的浓差电池,a电极上发生氧化反应,电极反应式为Cu-2e-=Cu2+,b电极上发生还原反应,电极反应式为Cu2++2e-=Cu。
A.该装置为原电池装置,将化学能转换为电能,故A错误;
B.根据分析可知b为正极,得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故B错误;
C.该电池是由于两侧溶液中硫酸铜的浓度差而形成,所以整个体系的最终状态应是两侧硫酸铜的浓度相等,此时将不再产生电流,而a电极反应式为Cu-2e-=Cu2+,b电极反应式为Cu2++2e-=Cu,若是铜离子发生迁移,则两侧溶液的浓度不可能相等,所以应该是SO![]() 穿过阴离子交换膜发生迁移,故C正确;
穿过阴离子交换膜发生迁移,故C正确;
D.当左右两池SO42-的浓度相等即均为![]() =0.2mol/L时,电池将停止工作,不再有电流产生,溶液中迁移的n(SO42-)=0.1L×(0.3-0.2)mol/L=0.01mol,所以外电路中转移电子的物质的量最多为0.02mol,故D错误;
=0.2mol/L时,电池将停止工作,不再有电流产生,溶液中迁移的n(SO42-)=0.1L×(0.3-0.2)mol/L=0.01mol,所以外电路中转移电子的物质的量最多为0.02mol,故D错误;
故答案为C。

练习册系列答案
相关题目