题目内容
【题目】下列判断正确的是( )
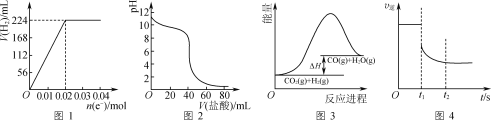
A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
【答案】CD
【解析】
A.电解NaCl溶液时,阴极始终是水电离生成的H+被还原为H2,因此氢气的体积随着转移电子的物质的量在不断增加,A项错误;
B.常温下0.1mol/L的NaOH溶液其pH是13,因此,滴定曲线中V(盐酸)=0mL即未滴加盐酸时,溶液的pH应为13,B项错误;
C.由图可知,该反应的![]() ,该反应能在高温下自发进行,根据
,该反应能在高温下自发进行,根据![]() 可知,该反应的
可知,该反应的![]() ,C项正确;
,C项正确;
D.t1时刻扩大容器体积,相当于降低体系的压强,因此t1时刻v逆会因为压强降低而减小;根据该反应的方程式可知,降低压强会使反应平衡逆向移动,NH3的量会逐渐下降,因此v逆会进一步减小直至达到新的平衡状态,D项正确;
答案选CD。

【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL某浓度的稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 0 | 50 | 120 | 232 | 290 | 310 |
(1)2~3min段的反应速率比1~2min段的反应速率__________(填“块”或“慢”),原因是______;
(2)求2~3min段以HCl的浓度变化来表示的平均反应速率(设溶液体积不变)____________;
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号)____________。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液