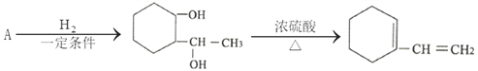
题目内容
【题目】工业上用铝土矿(主要成分为A12O3,含FeO杂质)为原料冶炼铝的工艺流程如下:

下列说法正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸溶液
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=A1(OH)3↓+NaHCO3
【答案】D
【解析】
由溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳,故试剂X为氢氧化钠溶液,氧化铁与氢氧化钠不反应,沉淀为氧化铁;氢氧化铝加热分解生成氧化铝,电解氧化铝生成铝和氧气。
A、由溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳,故试剂X为氢氧化钠溶液,不可能为盐酸,故A错误;B、氧化铁与氢氧化钠不反应,反应①后过滤所带沉淀为氧化铁,故B错误;C、电解熔融氧化铝生成铝和氧气属于氧化还原反应,故C错误;D、过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,反应方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,故D正确;故选D。

 快乐5加2金卷系列答案
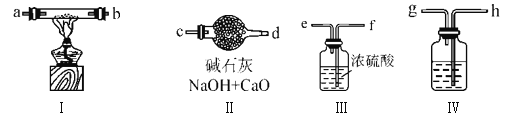
快乐5加2金卷系列答案【题目】某化学兴趣小组拟用如下图装置制备氢氧化亚铁并观察其颜色。

提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在_____________中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,可将仪器中的空气排尽,具体操作为:关闭开关_______,打开开关________,打开分液漏斗活塞;待反应一段时间排尽空气后,再关闭开关_______,打开开关_______,就可观察到氢氧化亚铁的颜色。试分析实验开始时需排尽装置中空气的理由_______________________________(用化学反应方程式作答)。
(3)某同学认为本实验中应该用铁钉代替铁粉,他的理由是________________________。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①从摩尔盐水溶液中提取 (NH4)2SO4·FeSO4·6H2O晶体的具体操作是______________,用乙醇洗涤,干燥。
②为了测定产品的纯度,称取10 g产品溶于50 mL水中,配制成250 mL溶液,用浓度为0.01 mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
通过实验数据计算的该产品纯度为________,上表中第一次实验中记录数据明显大于后两次,其原因可能是________。
A.第一次滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.第一次实验结束时俯视刻度线读取酸性高锰酸钾溶液的体积
C.第一次滴定用的锥形瓶用待测液润洗过
D.第一次实验装高锰酸钾的滴定管清洗后没有润洗